
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃分子中的C%越大
C. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4;否则y<4
D. 相同质量的烃,完全燃烧,消耗O2越多,烃中含H%越高
【答案】D
【解析】A、机物燃烧生成物质的量相等的CO2和H2O,则有机物中碳原子和氢原子个数之比是1:2;
B、相同物质的量的烃完全燃烧,产生二氧化碳的量的多少和分子式中碳原子数有关;
C、设烃的分子式为CxHy,根据烃燃烧的化学方程式,结合反应前后体积的变化进行判断;
D、相同质量的烃CxHy,完全燃烧,y/x越大,消耗CxHy越多。
详解:A、机物燃烧生成物质的量相等的CO2和H2O,,则有机物中碳原子和氢原子个数之比是1:2,不能确定是否含有氧元素,故A错误;
B、同物质的量的烃完全燃烧,产生二氧化碳的量的多少和分子式中碳原子数有关,相同质量的烃,完全燃烧,生成的CO2越多,说明烃中的C%越大,故B错误;
C、有机物燃烧的化学方程式为:CxHy+(x+![]() )O2==xCO2+
)O2==xCO2+![]() H2O,反应前后气体体积不变(温度>100℃,则1+x+
H2O,反应前后气体体积不变(温度>100℃,则1+x+![]() =x+
=x+![]() ,所以y=4,若体积减小,则1+x+
,所以y=4,若体积减小,则1+x+![]() >x+
>x+![]() ,若体积减少,则y<4;否则y>4,故C错误;
,若体积减少,则y<4;否则y>4,故C错误;
D、相同质量的烃CxHy,完全燃烧,消耗![]() 越多,则
越多,则![]() 越大,即烃中含H%越高,所以D选项是正确的。
越大,即烃中含H%越高,所以D选项是正确的。
所以D选项是正确的。


科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)==2C(g)+D(g),经2min后B的浓度减少0.6mol·L-1,下列说法正确的是
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 在2min末的反应速率,用B表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3:2:1
D. 在这2min内B和C两物质浓度是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 0.01molL﹣1的HA溶液中逐滴加入0.02molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( ) 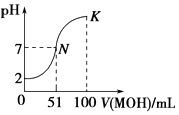
A.HA为弱酸
B.常温下,MA溶液的pH>7
C.K点对应的溶液中:c(M+)+c(MOH)=c(A﹣)
D.在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH﹣)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将FeCl3、CuCl2混合溶液加入一定质量的铁粉中充分反应,所加混合溶液的体积与反应后剩余固体质量如图所示。已知原混合溶液中Fe3+浓度为0.200 mol/L,经检测M点时溶液中无Cu2+;
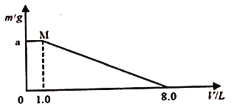
求:
(1)c(CuCl2 )=______mol·L-1。
(2)铁粉的质量_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为______________________(写出一种即可)。
(2)25℃ 101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无无CH4和O2剩余且无固体物质生成,装置内气体全部通入足量的碱石灰后,剩余bmol气体。则:
①反应开始时CH4与O2的物质的量之比为___________________________。
②若已知 C(s) + O2(g) = CO2(g) △H1= -m kJ/mol
CO2(g) + C(s) = 2CO(g) △H2= +n kJ/mol
则表示CH4燃烧热的热化学方程式为_____________________________________________。
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应,
NO+NO2+Na2CO3===2NaNO2+CO2,2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为____________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是___________________。
(4)氮的固定是几百年来科学家一直研究的课题
①20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如图所示,正极的电极反应式是___________________________________。
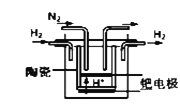
②近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)≒4NH3(g)+3O2(g),则其反应热△H=________________。
(已知:N2(g)+3H2(g)≒2NH3(g)△H=﹣92.4kJ.mol﹣1,2H2(g)+O2(g)≒2H2O(l) △H=﹣571.6kJ.mol﹣1 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)D在周期表中的位置___________;
(2)元素C、D、E形成的原子半径大小关系是______________(用元素符号表示)。
(3)C、D可形成化合物D2C2,D2C2含有的化学键类型有______________________;
(4)A、C两种元素形成的原子个数之比为1:1的化合物电子式________________;
(5)B的氢化物与B的最高价氧化物的水化物反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+
B.尼泊金酸( ![]() )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应: ![]()
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH﹣ ![]() CH3COO﹣+NH4++2Ag↓+3NH3+H2O
CH3COO﹣+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com