
【题目】下列反应中,通入的气体物质只作为氧化剂的是
A.二氧化硫通入溴水溶液中B.氯气通入氯化亚铁溶液中
C.一氧化碳气体通入灼热的CuO中D.二氧化氮通入水中
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】25℃时,四种均为0.1molL﹣1的溶液,其pH如下表所示:
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
下列关系不正确的是
A. 酸性:H2CO3 > ![]()
B. 水电离产生的c(H+):① = ②
C. 溶液③中:c(HCO3﹣)+ c(CO32﹣)+ c(H2CO3)= 0.1molL﹣1
D. 溶液④中:c(Na+)> c(![]() )> c(OH-)> c(H+)
)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中关于物质分类的正确组合是( )
组合类别 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | H2O2 | CH3COOH | KOH | CaCl2 |
D | CO2 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液为实验对象,可探究盐的性质和盐溶液间反应的多样性
实验 | 试剂 | 现象 | 检验 结果 | |
滴管 | 试管 | |||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 | 产物为Ag2SO3 |
0.2 mol·L1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | 产物含Cu+、Cu2+和SO32 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | 产物为 Al(OH)SO3 | ||
下列说法不正确的是
A. 现象Ⅰ对应的离子方程式:Ag2SO4(s) + SO32(aq) === Ag2SO3(s) + SO42(aq)
B. 用稀硫酸证实Ⅱ沉淀中含有Cu+的实验现象是析出红色固体
C. 现象Ⅲ中白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色
D. 上述实验现象涉及了亚硫酸盐的溶解性、氧化还原性及其水溶液的酸碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
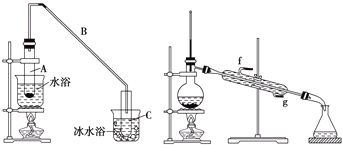
【题目】化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知: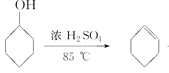 +H2O
+H2O
密度 | 熔点 | 沸点 | 溶解性 | |
环己醇 |
| 25 | 161 | 能溶于水 |
环己烯 |
|
| 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
导管B除了导气外还具有的作用是______。
②试管C置于冰水浴中的目的是______。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等![]() 加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
A.KMnO4溶液![]() 稀H2SO4 C.Na2CO3溶液
稀H2SO4 C.Na2CO3溶液
②再将环己烯按上图装置蒸馏,冷却水从______口进入![]() 填“g”或“f”),蒸馏时要加入生石灰,其目的是______。
填“g”或“f”),蒸馏时要加入生石灰,其目的是______。
③收集产品时,控制的温应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是_____。
A.蒸馏时从![]() 开始收集产品
开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是______。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析正确的是
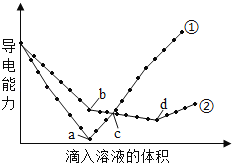
A. ②代表滴加H2SO4溶液的变化曲线
B. b点,两反应物物质的量之比为1: 2
C. a、d两点对应的溶液均显中性
D. c点,两溶液中含有相同物质的量浓度的OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
A、容器内气体密度保持不变
B、容器内温度不再变化
C、断裂1mol N≡N键的同时,生成6mol N﹣H键
D、反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g) = ZnO(s) △H =-348.3 kJ/mol
②2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H=________ kJ/mol。
(3)已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g)△H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________。
(4)在水溶液中,YO3n-和S2-发生反应的离子方程式如下:YO3n- + 3S2- + 6H+ = Y-+ 3S↓+ 3H2O
①YO3n-中Y的化合价是_____________;
②Y元素原子的最外层电子数是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com