
【题目】下列试管中,不同条件下反应:Fe+2HCl=FeCl2+H2↑,判断产生H2的反应速率最小的是
试管 | 盐酸浓度 | 温度 | 铁的状态 |
A | 0.5 mol/L | 20 ℃ | 块状 |
B | 0.5 mol/L | 20 ℃ | 粉末状 |
C | 2 mol/L | 35 ℃ | 粉末状 |
D | 1 mol/L | 35 ℃ | 块状 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是

A. 在0.1 mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B. 当溶液的pH为7时,溶液的总体积为20 mL
C. 在B点所示的溶液中,浓度最大的阳离子是Na+
D. 在 A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应A(固)+2B(气)![]() C(气)+D(气)已达到平衡状态的是( )
C(气)+D(气)已达到平衡状态的是( )
A. 混合气体的压强 B. 混合气体的密度
C. 气体的总物质的量 D. A的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物性质的叙述错误的是( )
A. 甲烷和氯气在光照条件下反应产生油状液滴
B. 苯和乙醇均能使酸性高锰酸钾溶液褪色
C. 乙醇催化氧化能生成乙醛
D. 乙烯、苯分子中的所有原子均共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,若A容器中充满气体O2和B容器中充满气体O3
(1)若所含分子总数相等,则A容器和B容器的容积之比是____。
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是____。
(3)若两容器的体积比为3:2,则O2和O3物质的量之比为____,质量之比为____,密度之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
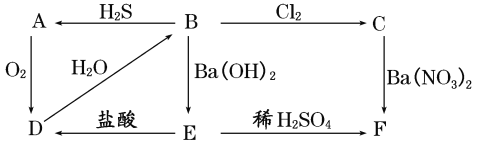
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液说法正确的是
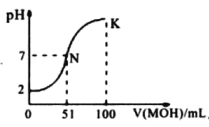
A. 1. 0mol/L NH4HCO3溶液pH=8.0,由此可知Ka1(H2CO3)>Kb (NH3·H2O)>Kaa2(H2 CO3)
B. 向氨水中加入NH4C1固体,溶液中c(NH3·H2O )·c(H+)/c(NH4+)增大
C. 向CH3 COONa溶液中滴加硫酸至中性时,c(SO42-)<c(CH3COOH)
D. 图中曲线可以表示向100mL0.01mol/LCH3COOH溶液中逐滴加入0.02 mol/LNaOH溶液的pH变化情况(溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为:
锌粒:Zn + 2OHˉ— 2eˉ= ZnO + H2O
石墨:O2 + H2 + 2eˉ = 2OHˉ。
根据判断,锌片
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com