
【题目】S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是( )
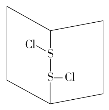
A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气和氨水在工农业生产中均有重要应用。
(1)工业合成氨反应的化学方程式是_________。
(2)实验室常加热熟石灰[主要成分是Ca(OH)2]和氯化铵混合固体制取氨气,写出反应的化学方程式___________。
(3)如图所示,向表面皿中的NaOH固体滴几滴浓氨水,迅速盖上盖,观察现象。
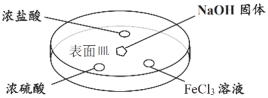
①___________液滴上方会出现白烟(填序号)
A.浓盐酸 B.浓硫酸 C.FeCl3溶液
②一段时间后浓硫酸的液滴中有白色固体,生成该白色固体的化学方程式是_______。
③FeCl3液滴中出现的现象是___________,发生反应的离子方程式是_________。
(4)利用氨水可以将大气污染物SO2吸收并生产氮肥,原理如图所示:
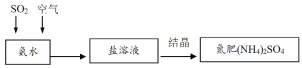
分析上述生产原理,在下列表格中填写该生产过程中利用的SO2的化学性质并进行理论论证
SO2的化学性质 | 理论论证 |
______ | ______ |
______ | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组研究含铁元素的盐类物质的制备、保存和性质。
实验I. 配制FeCl2溶液:向0.1 mol·L-1 FeCl3溶液中加入足量铁粉,充分振荡,备用。
(1)FeCl3溶液与铁粉反应的离子方程式是__________。
(2)在老师的指导下,配制的FeCl2溶液底部仍保留一层铁粉,请说明该操作的必要性__________。
实验II. 通过Fe(NO3)2的性质实验,探究试剂添加顺序的不同对现象和反应的影响。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 mol/L Fe(NO3)2溶液 | 实验i: 先滴加1.0 mL 0.5 mol·L-1 NaOH溶液; 再滴加1.5mL 1.0 mol·L-1 H2SO4溶液 | i. 滴加NaOH溶液后__________;加酸后溶液变为黄色 |
实验ii: 先滴加1.5 mL 1.0 mol·L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L-1 NaOH溶液 | ii. 加酸时溶液无明显现象;加碱后溶液依然没有明显变化 | ||
(3)实验i中滴加NaOH溶液后出现的一系列现象是__________;请用化学或离子方程式说明Fe(NO3)2溶液中滴加碱溶液后出现此系列现象的原因__________、__________。
(4)探究实验ii中先滴加H2SO4溶液时Fe(NO3)2溶液中是否发生了反应:
A. 向1.0 mL 0.1 mol·L-1 Fe(NO3)2溶液中__________(填写具体实验方法),溶液立即变红,说明加酸时溶液中发生了反应,生成了Fe3+。
B. 推测溶液中产生Fe3+的可能原因有两种:
a. 酸性条件下,__________;
b. 酸性条件下,Fe2+可能被空气中的O2氧化,写出相应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组拟探究改进Fe(OH)2的制取方法。
方案1:
①实验药品:FeS固体、稀硫酸溶液、NaHCO3溶液;
②实验装置如图1。
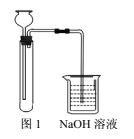
方案2:
①取一只试管,向其中加入一粒NaOH固体,再加入约2mL新制的FeSO4溶液;
②将试管置于酒精灯火焰上,对着有NaOH颗粒的部位小心加热(不能使液体剧烈沸腾)。使沉淀自下至上慢慢增多,观察下部沉淀颜色。
方案3:
①先在试管中滴入2~3 mL液体石蜡;
②用胶头滴管小心往试管底部注入4~5 mL新制的FeSO4溶液;
③再往试管中投入1粒绿豆大小的金属钠,观察反应现象。
回答下列问题:
(1)“方案1”中,后加入试管中的液体是______,NaOH溶液的作用是_______。
(2)“方案2”中,对着有NaOH颗粒的部位小心加热的目的是________。
(3)“方案2”的沉淀中,上层沉淀的颜色是________,下层沉淀的颜色是________,发生此现象的原因是________。
(4)“方案3”中反应的化学反应方程式为________。
(5)“方案3”的实验过程中间断性的出现白色沉淀,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH-△H>0,下列叙述正确的是( )
A. 向平衡体系中加入水,平衡正向移动,c (H+)增大
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量硫酸氢钠固体,  增大
增大
D. 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ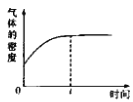
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,q是元素Y的单质且为淡黄色固体,n是元素Z的单质,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法一定正确的是
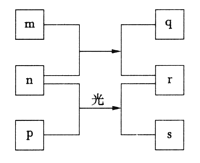
A.元素的非金属性:Z>Y
B.原子半径的大小:Z>Y>X>W
C.简单氢化物的稳定性:Z>Y>X
D.氧化物的对应水化物的酸性:Z>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com