
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,q是元素Y的单质且为淡黄色固体,n是元素Z的单质,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法一定正确的是
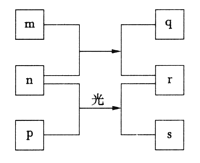
A.元素的非金属性:Z>Y
B.原子半径的大小:Z>Y>X>W
C.简单氢化物的稳定性:Z>Y>X
D.氧化物的对应水化物的酸性:Z>Y
科目:高中化学 来源: 题型:
【题目】S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是( )
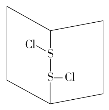
A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:

回答下列问题:
(1)反应I的化学方程式为2C+SiO2![]() Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2![]() Si+CO2↑(碳不足)和__________________________________(碳足量)。
Si+CO2↑(碳不足)和__________________________________(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
图中“操作X”的名称为______________________;PCl3的电子式为________________。
(3)反应IV的化学方程式为SiCl4+4NH3![]() Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据:
苯 | 溴 | 溴苯 | |
密度/g·cm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
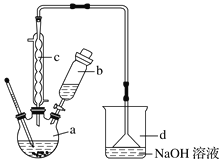
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体,继续滴加液溴滴完。铁屑的作用是___________;a中发生的化学反应方程式______________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A.重结晶B.过滤C.蒸馏D.萃取
(4)在该实验中,a的容积最适合的是_______(填入正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为___________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
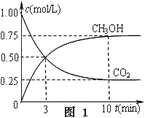

①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为___mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________(填“正向”、“逆向”或“不”)移动。
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为______。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为_____mol。
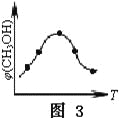
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3____0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是______(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)_____c(NH3·H2O)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别是__、__(填标号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)r(Li+)__r(H-),原因是___。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是__。中心原子的杂化形式为___。LiAlH4中,存在__(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图a的BornHaber循环计算得到。
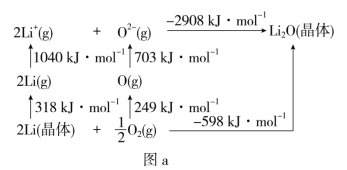
可知,Li原子的第一电离能为__kJ·mol-1,O=O键键能为__kJ·mol-1,Li2O晶格能为__kJ·mol-1。
(5)Li2O具有反萤石结构,晶胞如图b所示,已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为___g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
A. 向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
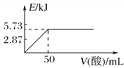
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氢气的标准燃烧热为241.8 kJ·mol-1
D. 若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是重要的半导体材料,是构成现代电子工业的基础。硅及其化合物在工业中应用广泛,在工业上,高纯硅可以通过下列流程制取:
![]()
完成下列填空:
(1)氯原子核外有_______种不同能量的电子,硅原子的核外电子排布式是_______________。
(2)碳与硅属于同主族元素,熔沸点SiO2 ________CO2 (填写“>”、“<”或“=”),其原因是_____________________________________________________。
(3)流程中由SiO2制粗硅的反应不能说明碳的非金属性强于硅,原因是_________________;请写出一个能说明碳的非金属性强于硅的化学方程式______________________________。
(4)SiHCl3(g) + H2(g)![]() Si(s) + 3HCl(g) -Q (Q>0)
Si(s) + 3HCl(g) -Q (Q>0)
①上述反应的平衡常数表达式K=_____________;能使K增大的措施是_______________。
②一定条件下,在固定容积的密闭容器中,能表示上述反应达到平衡状态的是________(选填编号)。
a.3v逆(SiHCl3)=v正(HCl) b.混合气体的压强不变
c.K保持不变 d.c(SiHCl3)∶c(H2)∶c(HCl)=1∶1∶3
③一定温度下,在2L密闭容器中进行上述反应,5min后达到平衡,此过程中固体质量增加0.28g,此时HCl的化学反应速率为 ________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁元素位于元素周期表中第______周期,第______族;
(2)Fe3+的电子排布式______
(3)Fe2+的外围电子轨道表示式______
(4)为什么Fe3+在自然界Fe的各种存在形式中最为常见?______
(5)目前发现的铁的最高化合价是+6价,理论上最高价是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com