


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 |
| B、在“催化剂对过氧化氢分解反应速率的影响”实验中,MnO2的用量以及颗粒直径的大小均会影响H2O2分解的速率,但溶液的酸碱性对H2O2的稳定性没有影响 |
| C、用锌和稀硫酸制H2时,向稀硫酸溶液中加入少量CuSO4溶液,可以加快制取H2的速率 |
| D、将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
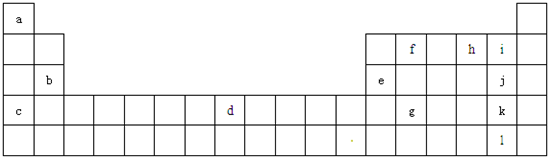
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
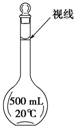 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
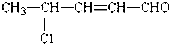 ,回答下列问题:
,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、己知C(s)+O2(g)=CO2(g);△H1C(s)+
| ||
| B、中和热△H=-57.3kJ?mol-1,所以1.00L 1.00mol?L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量 | ||
| C、用等体积的0.50mol?L-1盐酸、0.55mol?L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 | ||
| D、在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com