
【题目】联苯(![]() )由两个苯环通过单键连接而成,假定二氯联苯(联苯分子两个氢原子分别被两个氯原子所取代)分子中苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有(不含立体异构)
)由两个苯环通过单键连接而成,假定二氯联苯(联苯分子两个氢原子分别被两个氯原子所取代)分子中苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有(不含立体异构)
A.12种B.13种C.14种D.15种
【答案】A
【解析】
联苯中2个Cl可在同一苯环上,或在不同苯环上,以此来解答。
假设2个氯都在同一个苯环上,固定一个氯在靠近单键的第一个碳上,另一个氯移动,此苯环上另一个氯有四个位置,固定一个氯在靠近单键的第二个碳上,另一个氯移动,此苯环上另一个氯有二个位置,则当2个氯都在一个苯环上时共有6种异构;假设2个氯不在同一个苯环上,固定一个氯在靠近单键的第一个碳上,另一个氯移动,结合对称结构可知另一个氯只有3个位置,固定一个氯在靠近单键的第二个碳上,另一个氯移动,结合对称结构另一个氯只有2个位置,当2个氯都在单键对面的碳上时,只有一种,则两个氯不在同一个苯环上时共有6种异构;所以共有6+6=12种异构,故答案选A。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1 molNa在空气中完全燃烧,转移的电子数为2NA
B.常温下,2.7g铝与足量NaOH溶液反应,消耗0.1NA个水分子
C.0.1molFe与足量水蒸气反应生成H2的分子数为0.1NA
D.11.2LCl2含有的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL, Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是

A.点c对应的溶液中有:c(B+)+c(BOH)=0.1molL-1
B.点b对应的溶液中有:c(B+)=c(A-)
C.曲线甲表示BOH溶液的体积与pH的关系曲线
D.在由点a到点c的过程,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯度硅。以下是实验室制备SiCl4的装置示意图。

请回答下列问题:
(1)仪器D的名称_____________。
(2)装置A的硬质玻璃管中发生反应的化学方程式是________________。
(3)C中吸收尾气一段时间后,吸收液中存在多种阴离子,下列有关吸收液中离子检验的说法正确的是_____。
A.取少量吸收液加入AgNO3溶液,若生成白色沉淀,则说明一定存在Cl-
B.取少量吸收液,滴加溴水,若溴水褪色,则说明一定存在SO32-
C.取少量吸收液,加过量BaCl2溶液,过滤出沉淀,向沉淀中加过量稀盐酸,若沉淀部分溶解,且有气泡产生,则说明一定存在SO32-
D.取少量吸收液,加硫酸酸化后再加淀粉碘化钾溶液,若溶液变蓝,则说明一定存在ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A.在0~a范围内,只发生中和反应
B.a=0.3
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是
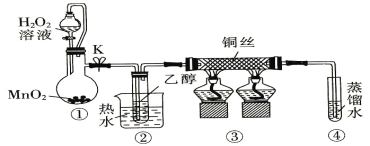
A.①中用胶管连接其作用是平衡气压,便于液体顺利流下
B.实验过程中铜丝会出现红黑交替变化
C.实验开始时需先加热②,再通O2,然后加热③
D.实验结束时需先将④中的导管移出,再停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是药物合成的一种中间体,可通过以下方法合成:

(1)B中官能团名称为_____________。
(2)G→H的反应类型为__________。
(3)已知C的一种同分异构体为: ,下列说法正确的是____________。
,下列说法正确的是____________。
a.能发生酯化反应
b.能发生银镜反应
c.1mol该物质完全水解能消耗3mol NaOH
d.该分子的核磁共振氢谱中峰面积之比为1∶2∶6∶2
e.其在酸性条件下的水解产物之一能与FeCl3溶液发生显色反应
(4) 中手性碳原子(一个碳原子上连有4个不一样的原子或者原子团)个数为________。
中手性碳原子(一个碳原子上连有4个不一样的原子或者原子团)个数为________。
(5)E的分子是为C14H17O3N,E经还原得到F,写出E→F的反应方程式:_______。
(6)已知:①
![]()

![]()

②苯胺( )易被氧化。请以甲苯和(CH3CO)2O为原料制备
)易被氧化。请以甲苯和(CH3CO)2O为原料制备![]() ,写出制备的合成路线流程图(无机试剂任选)。_________。
,写出制备的合成路线流程图(无机试剂任选)。_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量NOx和SO2,可经处理消除。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+ 4NO2(g) 4NO(g)+CO2(g)+ 2H2O(g); H1=574.0 kJ ·mol-1
CH4(g)+4NO(g) 2N2(g)+ CO2(g)+ 2H2O(g); H2= 1160.0 kJ·mol-1
①反应CH4(g)+2NO2(g) N2(g)+CO2(g)+ 2H2O(g); H3=_____;
②若该反应中将NOx还原为N2,消耗标准状况下5.6L CH4,则反应过程中转移的电子物质的量为___;
(2)用CH4原NO2的反应为CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),向两个容积均为2L温度分别为T1°C、T2°C的恒温恒容密闭容器中分别加入物质的量为1 mol的CH4和2molNO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1_______T2(填“>”或“<”);
②T1°C时,40~80 min,用N2的浓度变化表示的平均反应速率为v(N2)=_____,此温度下的化学平衡常数K=______;
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_____移动(填“正向”、 “逆向”或“不”);
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)碱性混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2反应的离子方程式:__________________________;
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是____________________________ ( 答出一点即可);

(4)用碱液脱硝是目前研究的课题之一。
①将NO、NO2 控制物质的量之比接近1:1通入足量氢氧化钠溶液可制NaNO2溶液。请写出该反应的离子方程式______________________________。
②将工业上氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到下图所示的电解槽中进行电解。写出A室NO2发生的电极反应:____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com