
����Ŀ��������66�Ǻ����ļ��ĸ߷��ӻ�����������������������ȣ��������·����ϳɣ���֪��A��E��Ϊͬ���칹�壬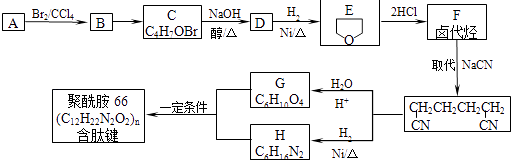
���������գ�
��1��A��B�ķ�Ӧ���� �� A�к��������ŵ����� ��
��2��B�Ľṹ��ʽ �� D���ܵĽṹ��ʽ ��
��3��F���������Ƶ��Ҵ���Һ���ȵõ���I��I������ �� ��I��һ��̼ԭ�ӵ�ͬϵ�������ʵ����巴Ӧ���ɶ������Ľṹ��ʽ��ȷ���� �� a�� ![]()
b�� ![]()
c�� 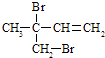
d�� 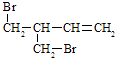
��4��G��H��Ӧ���ɾ�����66�Ļ�ѧ����ʽ�� ��
��5��ͬʱ��������������G��ͬ���칹��Ľṹ��ʽΪ �� �ٺ�һ�ֹ����� ���ܷ���������Ӧ �ۺ����������ֻ�ѧ������ͬ����ԭ�ӣ�
���𰸡�
��1���ӳɷ�Ӧ���ǻ�
��2��CH2BrCHBrCH2CH2OH��![]() ��
�� ![]()
��3��1��3������ϩ��ac
��4��nHOOC��CH2��4COOH+nH2N��CH2��6NH2+2n H2O ![]()
![]()
��5��HCOOCH��CH3��CH��CH3��OOCH
���������⣺�ɺϳ�����ͼ��֪��A���巢���ӳɷ�Ӧ��B��B������Ϣ���ȡ����Ӧ��C����B�����ǻ���±ԭ�ӣ����E�Ľṹ�Լ�A��E��Ϊͬ���칹�壬��֪��AΪCH2=CHCH2CH2OH������BΪCH2BrCHBrCH2CH2OH��CΪ ![]() ��DΪ
��DΪ ![]() ��
�� ![]() ��E��2����HCl��Ӧ��F��F��NaCN����ȡ����Ӧ����NCCH2CH2CH2CH2CN��FΪClCH2CH2CH2CH2Cl��NCCH2CH2CH2CH2CNˮ���GΪHOOCCH2CH2CH2CH2COOH��NCCH2CH2CH2CH2CN�����������ӳɷ�Ӧ��HΪH2NCH2CH2CH2CH2CH2CH2NH2 �� G��H�������۷�Ӧ��J��������66����1����������ķ�����֪��A��B�ķ�Ӧ����Ϊ�ӳɷ�Ӧ��A�к��������ŵ�����Ϊ�ǻ������Դ��ǣ��ӳɷ�Ӧ���ǻ�����2����������ķ�����֪��BΪCH2BrCHBrCH2CH2OH��DΪ
��E��2����HCl��Ӧ��F��F��NaCN����ȡ����Ӧ����NCCH2CH2CH2CH2CN��FΪClCH2CH2CH2CH2Cl��NCCH2CH2CH2CH2CNˮ���GΪHOOCCH2CH2CH2CH2COOH��NCCH2CH2CH2CH2CN�����������ӳɷ�Ӧ��HΪH2NCH2CH2CH2CH2CH2CH2NH2 �� G��H�������۷�Ӧ��J��������66����1����������ķ�����֪��A��B�ķ�Ӧ����Ϊ�ӳɷ�Ӧ��A�к��������ŵ�����Ϊ�ǻ������Դ��ǣ��ӳɷ�Ӧ���ǻ�����2����������ķ�����֪��BΪCH2BrCHBrCH2CH2OH��DΪ ![]() ��
�� ![]() �����Դ��ǣ�CH2BrCHBrCH2CH2OH��
�����Դ��ǣ�CH2BrCHBrCH2CH2OH�� ![]() ��
�� ![]() ����3��FΪClCH2CH2CH2CH2Cl��F���������Ƶ��Ҵ���Һ���ȷ�����ȥ��Ӧ�õ���IΪCH2=CHCH=CH2 �� I������Ϊ1��3������ϩ����I��һ��̼ԭ�ӵ�ͬϵ��ΪCH2=C��CH3��CH=CH2��CH2=CHCH=CHCH3��CH2=CHCH2CH=CH2 �� ������ʵ����巴Ӧ���ɶ������Ϊ
����3��FΪClCH2CH2CH2CH2Cl��F���������Ƶ��Ҵ���Һ���ȷ�����ȥ��Ӧ�õ���IΪCH2=CHCH=CH2 �� I������Ϊ1��3������ϩ����I��һ��̼ԭ�ӵ�ͬϵ��ΪCH2=C��CH3��CH=CH2��CH2=CHCH=CHCH3��CH2=CHCH2CH=CH2 �� ������ʵ����巴Ӧ���ɶ������Ϊ ![]() ��
�� 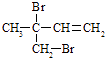 �ȣ���ѡac�����Դ��ǣ�1��3������ϩ��ac����4��G��H��Ӧ���ɾ�����66�Ļ�ѧ����ʽΪnHOOC��CH2��4COOH+nH2N��CH2��6NH2+2n H2O
�ȣ���ѡac�����Դ��ǣ�1��3������ϩ��ac����4��G��H��Ӧ���ɾ�����66�Ļ�ѧ����ʽΪnHOOC��CH2��4COOH+nH2N��CH2��6NH2+2n H2O ![]()
![]() �����Դ��ǣ�nHOOC��CH2��4COOH+nH2N��CH2��6NH2+2n H2O
�����Դ��ǣ�nHOOC��CH2��4COOH+nH2N��CH2��6NH2+2n H2O ![]()
![]() ����5��GΪHOOCCH2CH2CH2CH2COOH�����������ٺ�һ�ֹ����ţ����ܷ���������Ӧ��˵������ȩ�������ij�����ۺ����������ֻ�ѧ������ͬ����ԭ�ӣ������������G��ͬ���칹��Ľṹ��ʽΪ HCOOCH��CH3��CH��CH3��OOCH�����Դ��ǣ�HCOOCH��CH3��CH��CH3��OOCH��
����5��GΪHOOCCH2CH2CH2CH2COOH�����������ٺ�һ�ֹ����ţ����ܷ���������Ӧ��˵������ȩ�������ij�����ۺ����������ֻ�ѧ������ͬ����ԭ�ӣ������������G��ͬ���칹��Ľṹ��ʽΪ HCOOCH��CH3��CH��CH3��OOCH�����Դ��ǣ�HCOOCH��CH3��CH��CH3��OOCH��


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д� �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl���㷺�����л��ϳɡ��������ա�ұ��ҽҩ��������ҵ��
��1����ҵ���Ȼ���ͭ�������з�Ӧ�Ʊ���2CuSO4+Na2SO3+2NaCl+Na2CO3��2CuCl��+3Na2SO4+CO2�����Ʊ���������Ҫ20%��CuSO4��Һ������100g ��CuSO4��Һ��Ҫ����g����Ҫˮg��
��2��ʵ���ҿ������·����Ʊ�����CuCl��ȡ10mL 0.2mol/L CuCl2��Һ������0.128gͭм��36.5%��Ũ���ᣨ�ܶ�Ϊ1.2g/mL��3mL�����ܱ������м��ȣ���ַ�Ӧ�õ���ɫ��ҺA������ҺAȫ������ˮ�У��ɵõ���ɫ���Ȼ���ͭ��������֪��ҺA��ֻ�������Ӻ����������ӣ�������ˮ�ĵ��룩�����У�n��H+��=0.036mol��n��Cl����=0.032mol����ͨ�������ͼ��㣬ȷ����ҺA����һ�����ӵĻ�ѧʽ�����ʵ�����
��3����CO2��O2��CO��N2��ɵĻ������1.008L��������ܶ�Ϊ1.429g/L��������������ͨ��������30%KOH��Һ���Ȼ���ͭ����Һ������ȫ����O2��CO�����ٶ�ÿһ����Ӧ���ܽ�����ȫ����ʹ����Һ��ֱ�����0.44g��0.44g��������ܶȾ��ڱ�״���²ⶨ�����û�������Ħ��������g/mol�����������n��CO2����n��CO��N2��= ��
��4����ʽ���㣺�ٻ��������CO�������Ƕ��٣�
�����ʣ�����������Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʲ�����һ���Լ�ͨ����ѧ��Ӧ���ֵ���(����)
A.MnO2��������CuO��������FeO
B.(NH4)2SO4 K2SO4 NH4Cl
C.AgNO3 KNO3 Na2SO3
D.Na2CO3 NaHCO3 K2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о����֣�������ʯī������������������������CaF2��CaO������ʣ�������ͼ��ʾװ�û�ý����ƣ����Ը�Ϊ��ԭ������ԭ���������Ʊ������ѣ�����������ȷ���ǣ� �� 
A.������������������
B.�������ų�������ֻ�Ǵ�����
C.TiO2����������ŵ�
D.�Ʊ�������ǰ��CaO����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��12�£�ȫ������������ٹ�·��������������й�˵������ȷ����

A. ������罫̫����ת��Ϊ����
B. ����β���е�CO2���������
C. ����������ȼú����ɼ�������
D. �����������̫���ܵ�ذ����Ҫ�����ǹ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��Һ�м���BaCl2��Һ���ټ���ϡ���ᣬ�����İ�ɫ��������ʧ������������ȷ���ǣ�������
A.��Һ��һ������SO42��
B.��Һ��һ������Ag+
C.��Һ��һ������SO32��
D.��Һ�п��ܺ���SO42����SO32����Ag+�е�ijһ�֡����ֻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤������ؾ����к�����Ԫ�أ�ѡ������������Լ��Ͳ���������֤�������˳����ȷ����
���μ�AgNO3��Һ ����ˮ�ܽ� �����ˡ�ȡ��Һ ����������̻�ϼ��� ����ϡ���� ����Ũ���ᷴӦ ����NaOH��Һ��ϼ��� ���õ���KI��ֽ����
A���ޢߢ٢� B���ޢ� C���ܢڢۢ٢� D���ڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����Ļ�ѧ��ʵ��������ֳ������������������������У�����ȷ����
A�������ڳ��������е�Ũ���ᣬ��Һ������������ˮ����
B���ڼ�������������Ũ���ᷴӦ�������ԡ�������
C��������Ũ���ᷴӦ�ġ��������ʵ������ˮ����
D��Ũ�������Ȼ��ƹ��巴Ӧ��HCl���ѻӷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ����Ҫ�Ļ���ԭ�ϣ��������ַ������ɵõ�����ͭ��
��֪��2NO2+2NaOH��NaNO3+NaNO2+H2O
NO+NO2+2NaOH��2NaNO2+H2O
�������漰�������������Ϊ��״�������ݣ���
��1��������a��Cu�ۣ��ڼ��ȵ������£��������ַ�Ӧ��Ȼ�����ɵ�CuOȫ������VmLϡ�����У��Ƶ�����ͭ��Һ��������ϡ�����Ũ������Ϊmol/L����Ҫ��������Ϊw%���ܶ�Ϊ��g/cm3��Ũ����mL����������ʽ��ʾ����
��2��������b��Cu�ۣ�ȫ�����ڹ�����ϡ�����У���Һ���������ˣ������ɵ�����ͨ������NaOH��Һ�в�ͬʱͨ���������������L����ʹ���ɵ�����������ȫ����������ʽ��ʾ����
��3������ȡijϡ�����ϡ����Ļ����Һ200mL��ƽ���ֳ����ݣ�������һ��������ͭ�ۣ�������ܽ�9.6g������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ����֪����ֻ����ԭΪNO���壩����ʽ����ԭ���������������ʵ����Ƕ��٣���������ʵ���Ũ�ȶ��٣�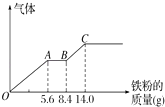
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com