
【题目】已知X、Y是同周期主族元素,且电负性X>Y,下列说法错误的是
A.位置关系:X在Y右侧B.第一电离能:X一定大于Y
C.简单气态氢化物稳定性:X大于YD.最高价含氧酸的酸性:X强于Y
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3,
(1)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_____,与CO互为等电子体的分子的电子式为______________。
(2)硝酸钾中NO3-的空间构型_____,与NO3-互为等电子体的一种非极性分子化学式为_____。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是________,配位体中提供孤对电子的原子是________。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有______形成.
a.离子键 b.配位键 c.非极性键 d.σ键
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,

写出该反应的化学方程式____________________。 若两个最近的Fe原子间的距离为s cm,则该晶体的密度是__________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.0g乙烷C2H6完全燃烧在常温下放出的热量为156kJ,则下列表示乙烷燃烧热的热化学方程式书写正确的是( )
A. 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) △H=-3120kJ/mol
B. C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
C. C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
D. C2H6(g)+ ![]() O2(g)=2CO2(g)+3H2O(1) △H=-1560kJ/mol
O2(g)=2CO2(g)+3H2O(1) △H=-1560kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,存在π键断裂的是
A.催化剂作用下,苯与液溴反应B.在光照条件下,CH4与Cl2反应
C.催化剂作用下,乙烯和氢气加成D.催化剂作用下,乙醇氧化为乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据,下列说法正确的是

A. 甲的金属性比乙弱
B. 乙的化合价为+1价
C. 丙一定为非金属元素
D. 丁一定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是__________ (填增大、不变、减小,以下相同)。②将容器的体积缩小一半,其正反应速率__________,其逆反应速率__________。③保持压强不变,充入N2使容器的体积增大,其正反应速率__________。
Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是__________ (填增大、不变、减小,以下相同)。②将容器的体积缩小一半,其正反应速率__________,其逆反应速率__________。③保持压强不变,充入N2使容器的体积增大,其正反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
A. 3.6mol/L B. 3.2mol/L C. 2.8mol/L D. 2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
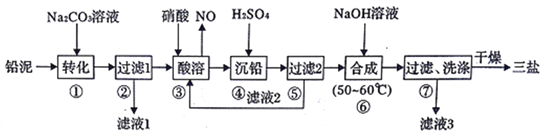
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。
请回答下列问题:
(1)步骤①转化的目的是_________,滤液1中的溶质为Na2CO3和______(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是____________________。(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________。
(3)滤液2中可循环利用的溶质为__________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×l0-5mol ·L-1,则此时c(SO42-)________mol·L-1。
(4)步骤⑥合成三盐的化学方程式为_________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__________。简述步骤⑦洗涤沉淀的方法_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种星际分子,其分子结构模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,不同花纹的球表示不同的原子)。

对该物质判断正确的是 ( )
A.①处的化学键是碳碳双键
B.②处的化学键是碳碳三键
C.③处的原子可能是氯原子或氟原子
D.②处的化学键是碳碳单键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com