
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
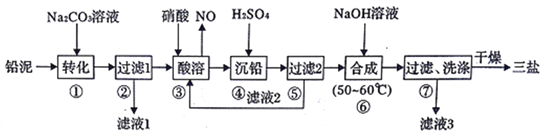
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。
请回答下列问题:
(1)步骤①转化的目的是_________,滤液1中的溶质为Na2CO3和______(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是____________________。(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________。
(3)滤液2中可循环利用的溶质为__________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×l0-5mol ·L-1,则此时c(SO42-)________mol·L-1。
(4)步骤⑥合成三盐的化学方程式为_________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__________。简述步骤⑦洗涤沉淀的方法_______________________。
【答案】 将PbSO4化为PbCO3提高铅的利用率 Na2SO4 适当升温(或适当增大硝酸浓度或减小沉淀粒直径等其他合理答案) 3Pb + 8H++2NO3 =3Pb2+ +2NO↑+4H2O2 HNO3 1.0×10 3 4PbSO4 +6NaOH ![]() 3Na2SO4+3PbO PbSO4 H2O + 2H2O 52% 用胶头滴管向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2 - 3次。
3Na2SO4+3PbO PbSO4 H2O + 2H2O 52% 用胶头滴管向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2 - 3次。
【解析】(1)步骤①铅泥在碳酸钠溶液中转化生成硫酸钠和碳酸铅,其目的是将PbSO4化为PbCO3提高铅的利用率;滤液1中的溶质为Na2CO3和Na2SO4;(2)影响化学反应速率的外界因素有温度、浓度、压强、催化剂、反应物的接触面积等,根据化工生产实际情况,步骤③酸溶时,为提高酸溶速率,可采取的措施是适当升温(或适当增大硝酸浓度或减小沉淀直粒径等;铅与硝酸反应生成Pb(NO3)2、水和NO,其反应离子方程式为:3Pb + 8H++2NO3- =3Pb2+ +2NO↑+4H2O;(3)酸溶时生成硝酸铅,硝酸铅在沉铅时与硫酸发生复分解反应生成硫酸铅和硝酸,则滤液2中可循环利用的溶质为HNO3,若步骤④沉铅后的滤液中c(Pb2+)=1.82×l0-5mol·L-1,则此时根据Ksp(PbSO4)=c(Pb2+)c(SO42-)可知, c(SO42-)=![]() =1.0×10-3mol·L-1;(4)步骤⑥在50-60℃条件下硫酸铅与氢氧化钠合成三盐的化学方程式为:4PbSO4 +6NaOH
=1.0×10-3mol·L-1;(4)步骤⑥在50-60℃条件下硫酸铅与氢氧化钠合成三盐的化学方程式为:4PbSO4 +6NaOH ![]() 3Na2SO4+3PbO PbSO4 H2O + 2H2O;假设铅泥中的铅元素有80%转化为三盐,若得到纯净干燥的三盐49.5t,则铅泥中铅元素的质量分数为:
3Na2SO4+3PbO PbSO4 H2O + 2H2O;假设铅泥中的铅元素有80%转化为三盐,若得到纯净干燥的三盐49.5t,则铅泥中铅元素的质量分数为: ![]() ×
×![]() ;(5) 洗涤沉淀的方法:用胶头滴管向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2-3次。
;(5) 洗涤沉淀的方法:用胶头滴管向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2-3次。


科目:高中化学 来源: 题型:
【题目】Cl2和SO2都具有漂白作用,能使品红溶液褪色.若将等物质的量的Cl2、SO2混合后,再通入品红与BaCl2的混合溶液,能观察到的现象是
①溶液很快褪色②溶液不褪色③出现沉淀④不出现沉淀.
A. ②③ B. ②④ C. ①② D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y是同周期主族元素,且电负性X>Y,下列说法错误的是
A.位置关系:X在Y右侧B.第一电离能:X一定大于Y
C.简单气态氢化物稳定性:X大于YD.最高价含氧酸的酸性:X强于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1molA和nmolB在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是()
2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是()
A. 当n=2时,物质A、B的转化率之比为1: 2
B. 起始时刻和达到平衡后容器中的压强比为(1+n):(l+n-a/2)
C. 当v (A)正=2v (C)逆时,可断定反应达到平衡
D. 容器中混合气体的密度不再随时间改变而改变,反应到达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锂电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
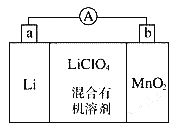
(1)外电路的电流方向是由____极流向___极(填字母)
(2)电池正极反应式___________。
(3)MnO2可与KOH和KClO3在高温下反应,生成反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X 、Y 、Z 、M 、N 、Q皆为1~20 号元素,其原子半径与主要化合价的关系如图所示。下列说法不正确的是( )

A. 1 mol 的QX2与足量X2Y 反应可产生2 md X2
B. 简单离子半径:Y 2—>N+>M 3+
C. 由X、Y、Z 三种元素形成的化合物只能是共价化合物
D. Z 、N 、M 的最高价氧化物的水化物两两间都能反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com