
【题目】下列物质的性质与应用均正确且二者具有对应关系的是 ( )
A.钠钾合金的导热性强,可用作快中子反应堆的热交换剂
B.氧化铁能与酸反应,可用于制作红色涂料
C.![]() 溶液显碱性,可用于除去锅垢中的硫酸钙
溶液显碱性,可用于除去锅垢中的硫酸钙
D.常温下铝与浓硝酸不反应,常用铝罐车运输浓硝酸
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如下图,下列说法正确的是
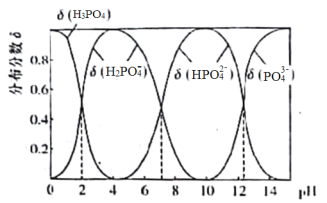

A.滴加NaOH溶液至pH=7,溶液中c(Na+)>c(H2PO4-)+c(HPO42—)+c(PO43—)
B.该温度下,H3PO4的三级电离常数Ka3>10-12
C.H3PO4的电离方程式为:H3PO4 3H+ + PO43—
D.滴加少量Na2CO3溶液,化学反应方程式为3 Na2CO3 + 2H3PO4=2Na2PO4+3H2O+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题
I.下列几种微粒或物质
①14C ②16O ③14N ④18O ⑤O2 ⑥O3
⑦CH3-CH3 ⑧C2H6 ⑨CH3- CH2-OH ⑩ CH3-O-CH3
(1)互为同位素的是______,(填序号,下同)质子数不同中子数相同的是______________
(2)互为同素异形体的是_________, 互为同分异构体的是_____________________
II.在25 C、101 kPa的条件下,

对于反应H2(g)+Cl2(g)= 2HCl(g), 测得生成2 mol HCI(g)时,反应过程中放出183 kJ的热量,则断开1 mol H- Cl键所需的能量是____ kJ.

III.如图所示的原电池装置中,正极的电极反应方程式是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种绿色晶体,易溶于水,难溶于乙醇等有机溶剂,光照或受热易分解。实验室要制备K3[Fe(C2O4)3]·3H2O并测定![]() 的含量。请回答下列相关问题。
的含量。请回答下列相关问题。
I.FeC2O4·2H2O的制备
向烧杯中加入5.0g(NH4)2Fe(SO4)2·6H2O、15mL蒸馏水、1mL3moL/L的硫酸,加热溶解后加入25mL饱和H2C2O4溶液,继续加热并搅拌一段时间后冷却,将所得FeC2O4·2H2O晶体过滤、洗涤。
(1)制备FeC2O4·2H2O时,加入3mol/L硫酸的作用是________________________。
II.K3[Fe(C2O4)3]·3H2O的制备
向I中制得的FeC2O4·2H2O晶体中加入10mL饱和K2C2O4溶液,水浴加热至40℃,缓慢加入过量3%的H2O2溶液并不断搅拌,溶液中产生红褐色沉淀,H2O2溶液完全加入后将混合物加热煮沸一段时间,然后滴加饱和H2C2O4溶液使红褐色沉淀溶解。向溶液中再加入10mL无水乙醇,过滤、洗涤、干燥。
(2)制备过程中有两个反应会生成K3[Fe(C2O4)3],两个化学方程式依次是:______________________、2Fe(OH)3+3K2C2O4+3H2C2O4=2K3[Fe(C2O4)3]+6H2O。
(3)H2O2溶液完全加入后将混合物加热煮沸一段时间的目的是______________________。
III.![]() 含量的测定
含量的测定
称取0.22gⅡ中制得的K3[Fe(C2O4)3]·3H2O晶体于锥形瓶中,加入50mL蒸馏水和15mL3mol/L的硫酸,用0.02000mol/L的标准KMnO4溶液滴定,重复3次实验平均消耗的KMnO4溶液体积为25.00mL。
(4)滴定时KMnO4溶液应盛放在_____________(填仪器名称)中,判断滴定终点的依据是_________________。
(5)滴定终点时,所得溶液中的溶质除硫酸外,还有__________________________(写化学式),K3[Fe(C2O4)3]·3H2O样品中![]() 的质量分数是____________________。
的质量分数是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1 mol/L Z的氢化物的水溶液中c(H+ )=0.1 mol/L,且Z与Y位于不同周期。下列叙述正确的是
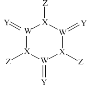
A.原子半径:W> X> YB.氢化物的沸点:Y >X> Z> W
C.X的氧化物的水化物是强酸D.Y的单质均具有杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0 g投入盛有 500mL0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
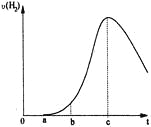
(1)曲线由0→a段不产生氢气的原因___________,有关反应的离子方程式为_______________;
(2)曲线由a→b段产生氢气的速率较慢的原因___________,有关的化学方程式______________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Br+H2![]() HBr+H的能量变化如图所示,根据图像判断下列说法正确的是( )
HBr+H的能量变化如图所示,根据图像判断下列说法正确的是( )
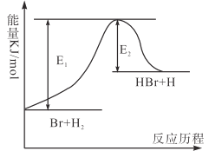
A.HBr的能量比H2的能量高
B.反应2C+O2=2CO的能量变化过程,与该图的变化过程相似
C.若该反应开始时加入催化剂,则反应达到平衡时吸收的能量增多
D.该反应中,H-H键断裂吸收的总能量大于H-Br键形成释放的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠。
I. 甲同学设计两种方案来检验![]() 是否发生变质。
是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠完全变质。
请你对两方案做出评价:
方案一:_________(填“合理”或“不合理”),理由是_____________________。
方案二:_________(填“合理”或“不合理”),理由是____________________。
Ⅱ. 乙同学为了探究![]() 是否发生变质,设计如下实验测定
是否发生变质,设计如下实验测定![]() 溶液的实际浓度。
溶液的实际浓度。

(1)①分液漏斗中应加入足量的________(填字母)。
a.浓硝酸 b.65%硫酸 c.浓盐酸
②装置B中盛装的试剂为_____________。
(2)实验前后测得装置C增重3.2g,则![]() 溶液实际的物质的量浓度为___________________(保留2位有效数字)。
溶液实际的物质的量浓度为___________________(保留2位有效数字)。
(3)该实验装置还存在一个明显的缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com