
【题目】已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠。
I. 甲同学设计两种方案来检验![]() 是否发生变质。
是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠完全变质。
请你对两方案做出评价:
方案一:_________(填“合理”或“不合理”),理由是_____________________。
方案二:_________(填“合理”或“不合理”),理由是____________________。
Ⅱ. 乙同学为了探究![]() 是否发生变质,设计如下实验测定
是否发生变质,设计如下实验测定![]() 溶液的实际浓度。
溶液的实际浓度。

(1)①分液漏斗中应加入足量的________(填字母)。
a.浓硝酸 b.65%硫酸 c.浓盐酸
②装置B中盛装的试剂为_____________。
(2)实验前后测得装置C增重3.2g,则![]() 溶液实际的物质的量浓度为___________________(保留2位有效数字)。
溶液实际的物质的量浓度为___________________(保留2位有效数字)。
(3)该实验装置还存在一个明显的缺陷是________________。
【答案】不合理 亚硫酸钠部分变质时加入稀盐酸也会产生气泡 不合理 亚硫酸钠也能与氯化钡反应生成白色沉淀,故亚硫酸钠未变质或部分变质时也会产生白色沉淀 b 浓硫酸 0.83 mol·L-l 缺少一个驱赶残留二氧化硫气体的装置(或其他合理答案)
【解析】
装置A是制备二氧化硫气体,通过装置B干燥二氧化硫气体,用装置C吸收二氧化硫,装置D是防止空气中的水蒸气和二氧化碳干扰二氧化硫气体质量的测定,据此分析解答。
I.方案一、加入稀盐酸有气泡生成,证明溶液中含有亚硫酸钠,Na2SO3溶液可能没有变质,也可能部分变质,故答案为:不合理;亚硫酸钠部分变质时加入稀盐酸也会产生气泡;
方案二、亚硫酸钠、硫酸钠都能与氯化钡反应生成亚硫酸钡、硫酸钡白色沉淀,故亚硫酸钠溶液未变质、部分变质、全部变质时的现象相同,都会生成白色沉淀,故答案为:不合理;亚硫酸钠也能与氯化钡反应生成白色沉淀,故亚硫酸钠未变质或部分变质时也会产生白色沉淀;
Ⅱ、(1)①装置中A是制备二氧化硫气体,a.浓硝酸有挥发性,且浓硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子,反应不能放出二氧化硫气体,错误;b.65%硫酸与亚硫酸钠反应放出二氧化硫,正确;c.浓盐酸与亚硫酸钠反应放出二氧化硫,但混入氯化氢气体,会对实验造成干扰,错误,故答案为:b;
②装置B是干燥生成的二氧化硫气体,可以选用液态干燥剂浓硫酸,故答案为:浓硫酸;
(2)C装置增重3.2g,产生的n(SO2)=![]() =0.05 mol,所以n(Na2SO3)=0.05 mol,则c(Na2SO3)=
=0.05 mol,所以n(Na2SO3)=0.05 mol,则c(Na2SO3)=![]() =0.83 mol·L-1,故答案为:0.83 mol·L-1;
=0.83 mol·L-1,故答案为:0.83 mol·L-1;
(3)二氧化硫会储存在某些装置中导致碱石灰吸收的二氧化硫减少,造成偏差,所以存在的缺陷是:缺少一个驱赶残留二氧化硫气体的装置,故答案为:缺少一个驱赶残留二氧化硫气体的装置。


科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,实验室通常利用干燥的氮气与晶体硅的粉末在1300~1400℃下反应制备氮化硅,所用装置如图所示(部分仪器已省略),下列说法错误的是

A.装置Ⅲ处省略了加热仪器酒精灯
B.装置Ⅱ所装试剂为浓硫酸
C.实验中要先对装置Ⅲ加热再打开分液漏斗活塞
D.若将晶体硅粉末分散在石棉绒中反应会更充分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与应用均正确且二者具有对应关系的是 ( )
A.钠钾合金的导热性强,可用作快中子反应堆的热交换剂
B.氧化铁能与酸反应,可用于制作红色涂料
C.![]() 溶液显碱性,可用于除去锅垢中的硫酸钙
溶液显碱性,可用于除去锅垢中的硫酸钙
D.常温下铝与浓硝酸不反应,常用铝罐车运输浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是 ( )
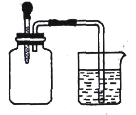
①H2、O2 ②Cl2、SO2
③NO2、O2 ④N2、H2
A.①②③B.②④
C.③④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷(CH4)是一种温室气体,NO是常见大气污染物,为消除空气中少量的CH4和NO,工业上可以设计如下反应:CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:
2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:

(1)根据上图判断该反应的T1________T2。(填“>”“<”或“=”)
(2)温度为T1,0~10 min内NO的平均反应速率v(NO)=___________,反应开始和平衡时容器的压强之比为___________。
(3)温度为T2,反应达到平衡时,NO的转化率为___________(保留3位有效数字)
(4)下列条件的改变不能加快反应速率的是___________。(填字母)
A.加入合适的催化剂 B.缩小容器体积
C.将CH4由0.4 mol改为0.8 mol D.分离出产物CO2
(5)CH4是重要的化石能源,完全燃烧生成CO2和H2O,放出大量热。若以熔融的K2CO3为电解质,可以设计成一种高温燃料电池,正极通入的气体是空气和CO2,负极反应式为:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点390℃,沸点430℃,易与水反应,可用锂与氨气加热反应制得。下面是实验室制备LiNH2时可能用到的装置图,回答下列问题:
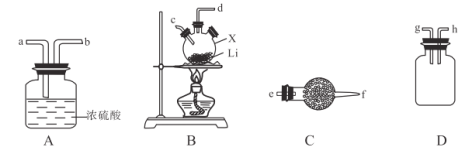
(1)仅从性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填字母)。
A.浓氨水、Ca(OH)2固体 B.浓氨水、CaO C.NH4Cl固体、Ca(OH)2固体
(2)选用(1)中适宜药品制取出的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处字母)。
(3)装置A的作用是_______________________。
(4)实验开始时,应先通入NH3后加热仪器X,原因是____________________。
(5)氨基锂能与水反应生成LiOH与一种气体,请设计实验证明制备的LiNH2中是否含有金属锂。_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋氨酸铜[Cux(Met)y,Met表示蛋氨酸根离子]是一种新型饲料添加剂。为确定蛋氨酸铜[Cux(Met)y]的组成,进行如下实验:
(1)称取一定质量的样品于锥形瓶中,加入适量的蒸馏水和稀盐酸,加热至全部溶解,冷却后将溶液分成两等份。
②取其中一份溶液,调节溶液pH在6~8之间。加入0.1000 mol/LI2的标准溶液25.00 mL,充分反应后滴入2~3滴指示剂X,用0.1000 mol/LNa2S2O3标准溶液滴定至蓝色恰好褪去,发生反应:![]() 。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
③向另一份溶液中加入NH3·H2O-NH4Cl缓冲溶液,加热至70℃左右,滴入2-3滴指示剂PAN,用0.02500 mol/LEDTA (Na2H2Y)标准溶液滴定其中Cu2+(离子方程式为Cu2++H2Y2--=CuY2-+2H+),消耗EDTA标准溶液28.00 mL。
(1)指示剂X为 ____。
(2)用Na2S2O3标准液滴定时,若pH过小,会有S和SO2生成。写出S2O32-与H+反应的离子方程式 ___________ 。
(3)若滴定管水洗后未用EDTA标准溶液润洗,测得Cu2+的物质的量将____(填“偏大”、“偏小”或“不变”)。
(4)通过计算确定蛋氨酸铜[Cux(Met)y]的化学式(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,请回答下列有关问题:
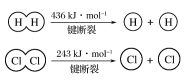
①由H+H→H2,当形成1 mol H—H键时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl—Cl键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
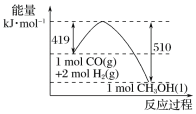
(2)①根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”) ________kJ能量。
②1mol CO(g)的总键能_______(填“>”、“=”或“<”)1mol CH3OH(l)的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)在生产和生活中有重要用途。已知Na2S2O3·5H2O遇酸立即分解:S2O32-+2H+=S↓+SO2↑+H2O。某研究小组在实验室模拟工业上硫化碱法制备Na2S2O3·5H2O流程如图所示:

吸硫过程实验装置如图所示:

回答下列问题:
(1)y仪器的名称________________。
(2)关闭K1,打开K2,反应开始,此时B装置的作用是________________。
(3)写出C装置中反应的离子方程式________________。
(4)装置D的作用是检验装置C中SO2的吸收效率,D中试剂是________________,表明SO2吸收效率低的实验现象是D中溶液________________。
(5)实验结束后,关闭K2,打开K1。玻璃液封管x中所盛液体最好为____________(填序号)。
A.NaOH溶液 B.浓硫酸 C.饱和NaHSO3溶液
(6)从滤液中获得较多Na2S2O3·5H2O晶体的实验操作依次为:________________,________________,过滤,洗涤,干燥。
(7)请设计实验检测制得的Na2S2O3·5H2O产品中是否含有Na2SO4杂质,简要说明实验操作及结论________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com