
【题目】甲烷(CH4)是一种温室气体,NO是常见大气污染物,为消除空气中少量的CH4和NO,工业上可以设计如下反应:CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:
2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:

(1)根据上图判断该反应的T1________T2。(填“>”“<”或“=”)
(2)温度为T1,0~10 min内NO的平均反应速率v(NO)=___________,反应开始和平衡时容器的压强之比为___________。
(3)温度为T2,反应达到平衡时,NO的转化率为___________(保留3位有效数字)
(4)下列条件的改变不能加快反应速率的是___________。(填字母)
A.加入合适的催化剂 B.缩小容器体积
C.将CH4由0.4 mol改为0.8 mol D.分离出产物CO2
(5)CH4是重要的化石能源,完全燃烧生成CO2和H2O,放出大量热。若以熔融的K2CO3为电解质,可以设计成一种高温燃料电池,正极通入的气体是空气和CO2,负极反应式为:_______________________________________________________。
【答案】< 0.02mol·L-1·min-1 1:1 62.5% D CH4+4CO![]() -8e-=5CO2+2H2O
-8e-=5CO2+2H2O
【解析】
(1)根据图像可知,T2温度下反应更快,先达到平衡,说明温度更高;
(2)M点CH4反应了0.1mol ,可以算出v(CH4),再根据v(NO)=4v(CH4)计算即可;恒温恒容时,压强之比等于物质的量之比,根据反应方程式可知,该反应前后气体物质的量不变的反应,所以压强不变;
(3)根据图,T2时CH4为0.15mol,说明CH4反应了0.25mol,则NO反应1mol;
(4)A. 催化剂能加快反应速率;
B. 缩小体积相当于增大压强,加快反应速率;
C. 增大了反应物CH4的浓度,加快反应速率;
D. 分离出产物CO2,并没有增大反应物浓度,不能加快反应速率;
(5)负极是CH4发生氧化反应。
(1)根据图像可知,T2温度下反应更快,先达到平衡,说明温度更高,所以T1<T2,故答案为:<;
(2)M点CH4反应了0.1mol ,可以算出v(CH4)=![]() = 0.005mol·L-1·min-1,所以v(NO)=4v(CH4)=0.02mol·L-1·min-1;恒温恒容时,压强之比等于物质的量之比,根据反应方程式可知,该反应前后气体物质的量不变的反应,所以压强不变,压强之比为1:1;
= 0.005mol·L-1·min-1,所以v(NO)=4v(CH4)=0.02mol·L-1·min-1;恒温恒容时,压强之比等于物质的量之比,根据反应方程式可知,该反应前后气体物质的量不变的反应,所以压强不变,压强之比为1:1;
故答案为:0.02mol·L-1·min-1;1:1;
(3)根据图,T2时CH4为0.15mol,说明CH4反应了0.25mol,则NO反应1mol,NO转化率为:![]() ×100% = 62.5%,故答案为:62.5%;
×100% = 62.5%,故答案为:62.5%;
(4)A. 催化剂能加快反应速率,A不符合题意;
B. 缩小体积相当于增大压强,加快反应速率,B不符合题意;
C. 增大了反应物CH4的浓度,加快反应速率,C不符合题意;
D. 分离出产物CO2,并没有增大反应物浓度,不能加快反应速率,D符合题意;
故答案为:D;
(5)负极是CH4发生氧化反应,反应式为:CH4+4CO![]() -8e-=5CO2+2H2O,故答案为:CH4+4CO
-8e-=5CO2+2H2O,故答案为:CH4+4CO![]() -8e-=5CO2+2H2O。
-8e-=5CO2+2H2O。


科目:高中化学 来源: 题型:
【题目】某有机物分子结构式如下图,下列说法正确的是( )

A. 取少量该有机物,滴加酸性高锰酸钾溶液,微热,有气体产生
B. 所有的碳原子不可能处在同一个平面上
C. 所有的氧原子不可能同时处在苯环平面上
D. 所有的氢原子有可能同时处在苯环平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1 mol/L Z的氢化物的水溶液中c(H+ )=0.1 mol/L,且Z与Y位于不同周期。下列叙述正确的是
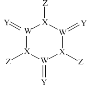
A.原子半径:W> X> YB.氢化物的沸点:Y >X> Z> W
C.X的氧化物的水化物是强酸D.Y的单质均具有杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Br+H2![]() HBr+H的能量变化如图所示,根据图像判断下列说法正确的是( )
HBr+H的能量变化如图所示,根据图像判断下列说法正确的是( )
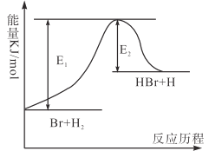
A.HBr的能量比H2的能量高
B.反应2C+O2=2CO的能量变化过程,与该图的变化过程相似
C.若该反应开始时加入催化剂,则反应达到平衡时吸收的能量增多
D.该反应中,H-H键断裂吸收的总能量大于H-Br键形成释放的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 电池可用于驱动无人潜航器。该电池以海水为电解质溶液,如图所示。该电池工作时,下列说法正确的是 ( )
电池可用于驱动无人潜航器。该电池以海水为电解质溶液,如图所示。该电池工作时,下列说法正确的是 ( )
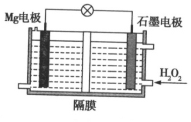
A.电池总反应是![]()
![]()
![]()
B.![]() 在石墨电极上反应放出氧气
在石墨电极上反应放出氧气
C.石墨电极附近溶液的pH增大
D.溶液中![]() 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠。
I. 甲同学设计两种方案来检验![]() 是否发生变质。
是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠完全变质。
请你对两方案做出评价:
方案一:_________(填“合理”或“不合理”),理由是_____________________。
方案二:_________(填“合理”或“不合理”),理由是____________________。
Ⅱ. 乙同学为了探究![]() 是否发生变质,设计如下实验测定
是否发生变质,设计如下实验测定![]() 溶液的实际浓度。
溶液的实际浓度。

(1)①分液漏斗中应加入足量的________(填字母)。
a.浓硝酸 b.65%硫酸 c.浓盐酸
②装置B中盛装的试剂为_____________。
(2)实验前后测得装置C增重3.2g,则![]() 溶液实际的物质的量浓度为___________________(保留2位有效数字)。
溶液实际的物质的量浓度为___________________(保留2位有效数字)。
(3)该实验装置还存在一个明显的缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液的pH通常在7.35-7.45之间的原因是血液中存在NaH2PO4-Na2HPO4等缓冲体系。常温下:Ka1(H3PO4)=7.6×10-3、Ka2(H3PO4)=6.3×10-8。下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1mol/L NaH2PO4溶液:2c(HPO42-)+3c(PO43-)>c(Na+)-c(H2PO4-)
B.常温下,pH=7的NaH2PO4和Na2HPO4的混合溶液:c(Na+)>c(HPO42-)>c(H2PO4-)
C.向10 mL0.1mol/L NaH2PO4溶液中加入5mL 0.4 mol/L NaOH溶液:c(H+)+3c(H3PO4)+2c(H2PO4-)+c(HPO42-)=c(OH-)
D.物质的量浓度相等NaH2PO4和Na2HPO4溶液等体积混合:3[c(H2PO4-)+c(HPO42-)+c(PO43-)]=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
A.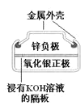 正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
B. 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
C.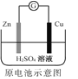 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
D.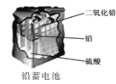 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授子对锂离子电池研究做出贡献的三位科学家。高能磷酸铁锂电池多应用于公共交通,内部结构如图,电池中间是聚合物的隔膜。电池在充电过程中,LiFePO4逐渐脱离出锂离子形成FePO4。下列叙述不正确的是
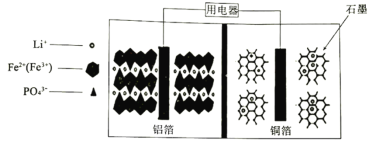
A.放电时Li+通过隔膜移向正极B.放电时正极反应式为:FePO4+Li++e-=LiFePO4
C.充电时铜箔连接电源负极D.充电时,每转移1mol电子,石墨增重12g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com