
【题目】2019年诺贝尔化学奖授子对锂离子电池研究做出贡献的三位科学家。高能磷酸铁锂电池多应用于公共交通,内部结构如图,电池中间是聚合物的隔膜。电池在充电过程中,LiFePO4逐渐脱离出锂离子形成FePO4。下列叙述不正确的是
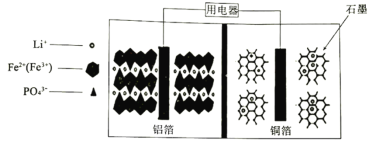
A.放电时Li+通过隔膜移向正极B.放电时正极反应式为:FePO4+Li++e-=LiFePO4
C.充电时铜箔连接电源负极D.充电时,每转移1mol电子,石墨增重12g
【答案】D
【解析】
电池在充电过程中为电解池,LiFePO4逐渐脱离出锂离子形成FePO4,Fe元素由+2价变为+3价,化合价升高,失电子,发生氧化反应,所在铝电极为阳极,则放电(原电池)时,FePO4所在铝电极为正极,发生得电子的还原反应,正极电极反应式为FePO4+Li++e-═LiFePO4,铜电极为负极,电极反应为:LixCn-xe-═xLi++nC;充电时为电解池,原电池的正、负极分别与电源的正、负极相接、作电解池的阳极、阴极,阳、阴极电极反应与原电池正、负极的恰好相反,电解质中阳离子移向阴极、阴离子移向阳极,据此分析解答。
A.放电时为原电池,原电池中,阳离子向正极移动,根据分析,铝电极为正极,Li+通过隔膜移向正极,故A正确;
B.根据分析,放电时正极反应式为:FePO4+Li++e-=LiFePO4,故B正确;
C.结合分析,充电时为电解池,原电池的正、负极分别与电源的正、负极相接,作电解池的阳极、阴极,铜箔为原电池的负极,应与电源负极连接,故C正确;
D.充电时,阴极反应式为nC+xLi++xe=LixCn,则通过1mol电子石墨电极增加1molLi+,增重质量为7g,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】甲烷(CH4)是一种温室气体,NO是常见大气污染物,为消除空气中少量的CH4和NO,工业上可以设计如下反应:CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:
2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:

(1)根据上图判断该反应的T1________T2。(填“>”“<”或“=”)
(2)温度为T1,0~10 min内NO的平均反应速率v(NO)=___________,反应开始和平衡时容器的压强之比为___________。
(3)温度为T2,反应达到平衡时,NO的转化率为___________(保留3位有效数字)
(4)下列条件的改变不能加快反应速率的是___________。(填字母)
A.加入合适的催化剂 B.缩小容器体积
C.将CH4由0.4 mol改为0.8 mol D.分离出产物CO2
(5)CH4是重要的化石能源,完全燃烧生成CO2和H2O,放出大量热。若以熔融的K2CO3为电解质,可以设计成一种高温燃料电池,正极通入的气体是空气和CO2,负极反应式为:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。如图是一个“化学多米诺实验”,已知:Cu2+ +4NH3.H2O= 4H2O+[Cu(NH3)4]2+ (该反应产物可作为H2O2分解的催化剂)。下列有关分析错误的是
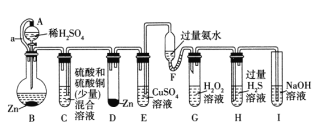
A.该实验成功的重要条件是整套装置气密性良好
B.A和B之间导管a的作用是平衡A和B内气压
C.B中反应速率大于D中反应速率
D.H中出现浅黄色浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成抗抑郁药物Prolitane的路线如下:
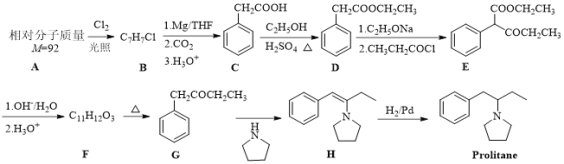
请回答以下问题:
(1)A的结构简式为_______。D的化学名称为_______,
(2)D→E的反应类型为_______。
(3) E的官能团名称为_______。
(4)F→G的化学方程式为_______。
(5) X 是D的同系物,满足下列条件的X共 ________种(不含立体异构)
①分子组成比D少一个CH2②能发生银镜反应③苯环上有两种不同化学环境的H,其中核磁共振氢谱显示为5组峰,其峰面积比为3∶2∶2∶2∶1,写出符合该要求的X的一种同分异构体的结构简式:_________________。
(6)参照Prolitane的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成路线(其他无机试剂和溶剂任选):__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,根据实验现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
A |
| Br2的CCl4溶液褪色 | 石蜡油分解产生乙烯气体 |
B |
| ③中出现气泡 | 可以用平衡移动原理解释 |
C |
| ①中出现白色沉淀 ②中出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
D |
| 淀粉碘化钾溶液变蓝 | b为直流电源负极 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)在生产和生活中有重要用途。已知Na2S2O3·5H2O遇酸立即分解:S2O32-+2H+=S↓+SO2↑+H2O。某研究小组在实验室模拟工业上硫化碱法制备Na2S2O3·5H2O流程如图所示:

吸硫过程实验装置如图所示:

回答下列问题:
(1)y仪器的名称________________。
(2)关闭K1,打开K2,反应开始,此时B装置的作用是________________。
(3)写出C装置中反应的离子方程式________________。
(4)装置D的作用是检验装置C中SO2的吸收效率,D中试剂是________________,表明SO2吸收效率低的实验现象是D中溶液________________。
(5)实验结束后,关闭K2,打开K1。玻璃液封管x中所盛液体最好为____________(填序号)。
A.NaOH溶液 B.浓硫酸 C.饱和NaHSO3溶液
(6)从滤液中获得较多Na2S2O3·5H2O晶体的实验操作依次为:________________,________________,过滤,洗涤,干燥。
(7)请设计实验检测制得的Na2S2O3·5H2O产品中是否含有Na2SO4杂质,简要说明实验操作及结论________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:I.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II.相关金属离子形成氢氧化物沉淀的pH范围:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 2.8 |
回答下列问题:
(1)滤渣②的成分是________________。
(2)写出“氧化”步骤中反应的化学方程式________________。
(3)“加热”操作的目的是________________。
(4)根据平衡移动原理解释酸化至pH=1的目的是________________(用离子方程式和适当文字说明)。
(5)通过下列实验可测定产品中K2Cr2O7(M=294g/mol)的纯度:称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(Cr2O72-的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/LNa2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。则所测定产品中K2Cr2O7的纯度为________________。
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。

①负极的电极反应式为________________;
②一段时间后,中间室NaCl溶液的浓度________________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
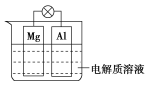
(1)电解质溶液为稀硫酸时,灯泡亮, Mg电极上发生的反应为____________;Al电极上发生的反应为________。溶液中![]() 向________移动(填“Mg电极”或“Al电极”)
向________移动(填“Mg电极”或“Al电极”)
(2)电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。_______________
a.若灯泡亮,Al电极为_______________(填“正极”或“负极”)。
b.若灯泡不亮,其理由为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2 。碳原子连有4个不同的原子或基团时,该碳称为手性碳,下列分析不正确的是
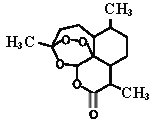
A. 推测青蒿素在乙醚中的溶解度大于在水中的溶解度
B. 青蒿素可以与NaOH、Na2CO3 、NaHCO3反应
C. 青蒿素分子中含有手性碳
D. 青蒿素中对热不稳定且具有氧化性的基团是“-O-O-”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com