
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
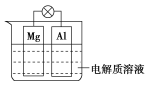
(1)电解质溶液为稀硫酸时,灯泡亮, Mg电极上发生的反应为____________;Al电极上发生的反应为________。溶液中![]() 向________移动(填“Mg电极”或“Al电极”)
向________移动(填“Mg电极”或“Al电极”)
(2)电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。_______________
a.若灯泡亮,Al电极为_______________(填“正极”或“负极”)。
b.若灯泡不亮,其理由为__________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
A. 正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
B. 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
C.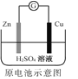 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
D. 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授子对锂离子电池研究做出贡献的三位科学家。高能磷酸铁锂电池多应用于公共交通,内部结构如图,电池中间是聚合物的隔膜。电池在充电过程中,LiFePO4逐渐脱离出锂离子形成FePO4。下列叙述不正确的是
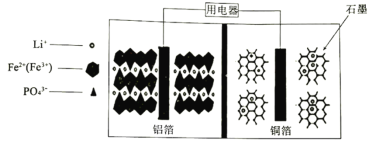
A.放电时Li+通过隔膜移向正极B.放电时正极反应式为:FePO4+Li++e-=LiFePO4
C.充电时铜箔连接电源负极D.充电时,每转移1mol电子,石墨增重12g
查看答案和解析>>
科目:高中化学 来源: 题型:
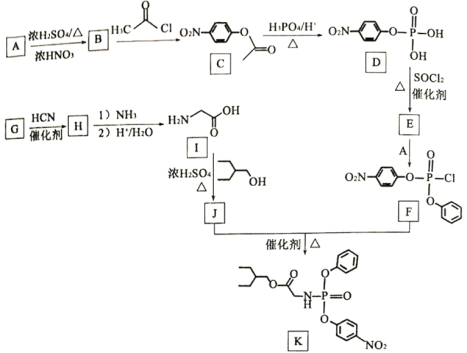
【题目】药物瑞德西韦(Remdesivir)对新型冠状病毒感染者有潜在的治疗效果:K为药物合成的中间体,其合成路线如图所示:
已知以下信息
①![]()
②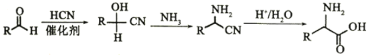
回答下列问题:
(1)B的化学名称为____________。
(2)J中含有官能团的名称为____________。
(3)由B生成C的反应类型为____________。
(4)由G生成H的化学反应方程式____________。
(5)E中含两个Cl原子,则E的结构简式____________。
(6)X是C的同分异构体,写出任意一个满足下列条件的X的结构简式____________。
①苯环上含有硝基且苯环上只有一种氢原子;
②遇FeCl3溶液发生显色反应:
③1mol的X与足量金属Na反应可生成2gH2。
(7)设计由苯甲醇(![]() )为原料合成化合物
)为原料合成化合物![]() 的路线____________(其他试剂任选)。
的路线____________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。
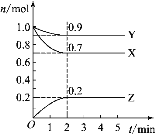
(1)由图中数据分析,该反应的化学方程式_____________。
(2)从反应开始至2 min,Z的平均反应速率为________。
(3)第5 min时,Z的生成速率________(填“大于”“小于”或“等于”)Z的消耗速率。
(4)第_______分钟时,反应达到平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种新型高分子材料的结构简式如图,对此高聚物叙述正确的是( )
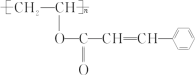
A.化学式为(C11H11O2)n
B.可以发生水解反应、氧化反应,不能发生取代反应
C.1mol该有机物分子最多能和4molH2发生加成反应
D.该高分子材料是由两种单体经酯化后加聚而成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)NH3的电子式______。
(2)氯化铵水溶液显酸性,其原因为______(用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体,溶液的pH______(填“升高”或“降低”);若加入少量的明矾固体后,请尝试从平衡移动的角度解释溶液中NH4+浓度的变化原因______。
(3)硝酸铵加热分解可得到N2O(g)和H2O(g),250℃时,硝酸铵在密闭容器中分解达到平衡,该温度下反应的平衡常数表达式为______;若有1mol硝酸铵完全分解,转移的电子数为______mol。
(4)3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,若反应放出9.2kJ 热量,则参加反应的氢气分子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
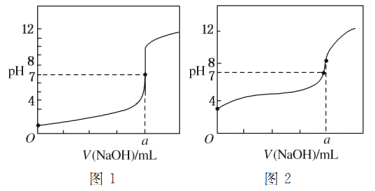
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图所示(电极均为石墨电极)。下列说法中正确的是( )

A. M为电子流出的一极
B. 通电使氯化钠发生电离
C. 电解一段时间后,阴极区pH降低
D. 电解时用盐酸调节阳极区的pH在2~3,有利于气体逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com