
����Ŀ������ѧ����ŵʵ������ֻ����Ƶ�һ����Ӧ�����÷�Ӧ�����������ѹ���ͺ�������ԭ����ʹ���ɻ�ѧʵ�����η�������ͼ��һ������ѧ����ŵʵ��������֪:Cu2+ +4NH3.H2O= 4H2O+[Cu(NH3)4]2+ (�÷�Ӧ�������ΪH2O2�ֽ�Ĵ���)�������йط����������
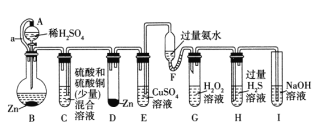
A.��ʵ��ɹ�����Ҫ����������װ������������
B.A��B֮�䵼��a��������ƽ��A��B����ѹ
C.B�з�Ӧ���ʴ���D�з�Ӧ����
D.H�г���dz��ɫ����
���𰸡�C
��������
A����װ�����������õ�ǰ���£�ͨ���ı�װ������ѹ����������Ӧ����A��ȷ��
B��B��ϡ�����п��Ӧ����H2����ѹ���ӣ���A��B֮�������˵���a����������ƽ��A��B����ѹ��ʹϡ����˳�����£�B�����ɵ�H2����C�У�C����ѹ���ӣ���C�е����������ͭ(����)�����Һ��ѹ��D�У� ��B��ȷ��
C����D��Zn������ͭ��Ӧ��������Cu��Zn�����ɵ�Cu����Һ���γ�ԭ��أ��ӿ�Zn������ķ�Ӧ�� B�з�Ӧ����С��D�з�Ӧ���ʣ���C����
D��D�����ɵ�H2����E�У�E����ѹ���ӣ���E�е�����ͭ��Һ��ѹ��F�У�Cu2+�Ͱ�ˮ������ɫCu( OH)2�����������ת��Ϊ�����Ե�[Cu(NH3)4]2+ �������뵽G�У���ʹH2O2�ֽ⣬H2O2�ֽ����ɵ�O2����H�к���H2S��Һ��Ӧ�����ɵ���ɫ��S�������ӷ�����H2S���屻NaOH��Һ���գ���D��ȷ��
��ѡC��


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����Ƴ���һ��Ư��Ч�ʼ��ߵ�����Ư��(�ṹ��ͼ��ʾ),����W��X��Y��Z��Ϊ������Ԫ����ԭ�����������������£�0.1 mol/L Z���⻯���ˮ��Һ��c(H+ )=0.1 mol/L����Z��Yλ�ڲ�ͬ���ڡ�����������ȷ����
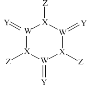
A.ԭ�Ӱ뾶:W> X> YB.�⻯��ķе�:Y >X> Z> W
C.X���������ˮ������ǿ��D.Y�ĵ��ʾ�����ɱ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѪҺ��pHͨ����7.35-7.45֮���ԭ����ѪҺ�д���NaH2PO4-Na2HPO4�Ȼ�����ϵ�������£�Ka1(H3PO4)=7.6��10-3��Ka2(H3PO4)=6.3��10-8������ָ����Һ�������ʵ���Ũ�ȹ�ϵ��ȷ����
A.0.1mol/L NaH2PO4��Һ��2c(HPO42-)+3c(PO43-)��c(Na+)-c(H2PO4-)
B.�����£�pH=7��NaH2PO4��Na2HPO4�Ļ����Һ��c(Na+)��c(HPO42-)��c(H2PO4-)
C.��10 mL0.1mol/L NaH2PO4��Һ�м���5mL 0.4 mol/L NaOH��Һ��c(H+)+3c(H3PO4)+2c(H2PO4-)+c(HPO42-)=c(OH-)
D.���ʵ���Ũ�����NaH2PO4��Na2HPO4��Һ�������ϣ�3[c(H2PO4-)+c(HPO42-)+c(PO43-)]=2c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Դ���ճ�����߿Ƽ������ж��й㷺Ӧ�á�����˵������ȷ����(����)
A.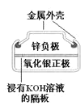 �����ĵ缫��ӦʽΪAg2O��2e-��H2O=2Ag��2OH-
�����ĵ缫��ӦʽΪAg2O��2e-��H2O=2Ag��2OH-
B. пͲ������������������Ӧ��пͲ��䱡
пͲ������������������Ӧ��пͲ��䱡
C.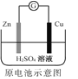 Zn2+��Cu�缫�����ƶ���Cu�缫������Һ��H+Ũ������
Zn2+��Cu�缫�����ƶ���Cu�缫������Һ��H+Ũ������
D.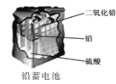 ʹ��һ��ʱ��������Һ�����Լ��������������½�
ʹ��һ��ʱ��������Һ�����Լ��������������½�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǣ�600�� ʱ����2L�ܱ�������A��B��C�����������ܱ������з�ӦʱŨ�ȵı仯������AΪ��ɫ���壬B��C����ɫ���塣���ͼ�з�������գ�
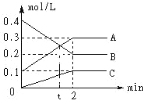
��1���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ_____
��2����Ӧ�ﵽƽ��״̬ʱ����Ӧ���ת����Ϊ_____
��3������Ӧ���е���_____min���÷�Ӧ�ﵽƽ�⡣
��4����Ӧ�ӿ�ʼ��2����ĩ��B�����ʵ���_____����B��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(B)=_
��5�����������ܱ�ʾ��Ӧ��ƽ��״̬����_____����ѡ���
a.������A��B�����ʵ������
b.�������������ɫ���ٸı�
c.�����ʵ�Ũ�ȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 24 g þ��27 g���У�������ͬ��������
B. ͬ�������������ͳ����У���������ͬ
C. 1 mol��ˮ��1 molˮ�У���������Ϊ2��1
D. 1 mol�����1 mol��ϩ�У���ѧ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�124 g P4������P��P����ĿΪ4NA
B. 100 mL 1mol��L1FeCl3��Һ������Fe3+����ĿΪ0.1NA
C. ��״���£�11.2 L�������ϩ������к���ԭ����ĿΪ2NA
D. �ܱ������У�2 mol SO2��1 mol O2����Ӧ���������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��ŵ������ѧ�����Ӷ�����ӵ���о�����������λ��ѧ�ҡ�����������﮵�ض�Ӧ���ڹ�����ͨ���ڲ��ṹ��ͼ������м��Ǿۺ���ĸ�Ĥ������ڳ������У�LiFePO4�������������γ�FePO4��������������ȷ����
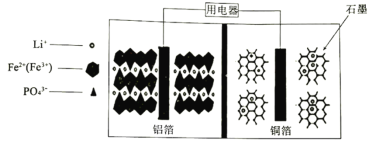
A.�ŵ�ʱLi��ͨ����Ĥ��������B.�ŵ�ʱ������ӦʽΪ��FePO4��Li����e����LiFePO4
C.���ʱͭ�����ӵ�Դ����D.���ʱ��ÿת��1mol���ӣ�ʯī����12g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϣ��ش��������⣺
��1��NH3�ĵ���ʽ______��
��2���Ȼ��ˮ��Һ�����ԣ���ԭ��Ϊ______�������ӷ���ʽ��ʾ����0.1mol/L�İ�ˮ�м���������NH4Cl���壬��Һ��pH______������������������������������������������������볢�Դ�ƽ���ƶ��ĽǶȽ�����Һ��NH4+Ũ�ȵı仯ԭ��______��
��3������識��ȷֽ�ɵõ�N2O��g����H2O��g����250��ʱ����������ܱ������зֽ�ﵽƽ�⣬���¶��·�Ӧ��ƽ�ⳣ������ʽΪ______������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ______mol��
��4��3H2��g��+N2��g��2NH3��g����H=-92kJ/mol������Ӧ�ų�9.2kJ ��������μӷ�Ӧ������������ĿΪ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com