
【题目】下列微粒既有氧化性又有还原性的是( )
A.H+
B.Fe2+
C.Cu2+
D.Al
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】如图所示,ΔE1=393.5 kJ,ΔE2=395.4 kJ,下列说法正确的是

A.1 mol石墨完全转化为金刚石需吸收1.9 kJ热量
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol金刚石和1 mol O2化学键断裂吸收的能量总和大于1 mol CO2分子中化学键断裂吸收的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4·6H2O晶体,实现有害物质的资源化利用。已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点。

(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为_______________。
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式:_________________。
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率。溶液pH对除铁效率影响如下图所示。

则除铁时应控制溶液的pH为____________(填序号)。
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为___________。
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是____________。
(4)从滤液中获取NiSO4·6H2O晶体的操作为________、冷却结晶、过滤、_________、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:

(1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是_______________。
(2)装置B中发生反应的离子方程式为_______________。
(3)装置C的作用是____________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
①检验洗涤已完全的方法是__________________。
②不用烘干的方式得到产品,其原因是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,_______________,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:①该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8,8.8);Cu(OH)2(4.2,6.7);Fe(OH)3(1.1,3.2)。②在水溶液中超过100℃,硫酸铜晶体易失去结晶水。③硫酸铜晶体溶解度曲线如右图所示]

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备:
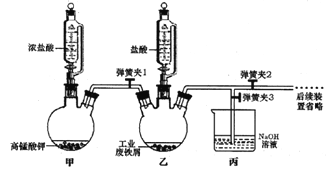
①实验过程中装置乙发生反应的离子方程式有________,仪器丙的作用为_________。
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为_______________。
③反应结束后,将乙中溶液边加入_____________,边进行加热浓缩、______、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
某兴趣小组将饱和FeC13溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeC13溶液浓度越大,水解程度越小 ②氯化铁的熔点为306℃、沸点为315℃ ,易升华,气态FeCl3会分解成FeCl2和Cl2③ FeC12熔点670℃)
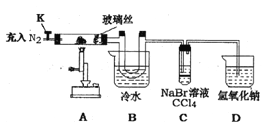
操作步骤 | 实验现象 | 解释原因 |
打开K , 充入氮气 | D中有气泡产生 | ①充入N2的原因________ |
关闭K, 加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________ |
实验结束,振荡C静置 | ③___________ | ④________________(用相关的方程式说明) |
⑤结合以上实验和文献资料,该固体可以确定的成分有______________________。 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子材料M其结构简式为![]() ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。

已知:① A分子中有两种不同环境的氢原子
② CH3CH2CH=CH2 ![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+ CH3CHO ![]()
![]()
请回答以下问题:
(1)A的结构简式为_____,B 的名称为_____,F中所含官能团的名称是______。
(2)①和③的反应类型分别是_______、______;反应② 的反应条件为_______。
(3)反应④的化学方程式为______________。
(4)有机物E有多种同分异构体,其中同时符合下列条件的同分异构体有_____________种。
① 属于芳香酯类 ② 其酸性水解产物遇FeC13 显紫色
(5)以l-丙醇和NBS为原料可以制备聚丙烯醇(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示:__________________
)。请设计合成路线(其他无机原料任选)并用如下方式表示:__________________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式________,并写出其所有可能的结构简式:___________________。
(2)两种气态烃以任意比例混合,在120℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体仍为10L。则两气态烃的分子的组成要符合的条件是_________________。
(3)如图所示,将浸透了石蜡油(分子中含有17个碳原子以上的液态烷烃混合物)的矿渣棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸气通过碎瓷片表面,发生反应,可得到一定量的气体生成物,用该生成物进行如下实验:
①生成的气体通入酸性KMnO4溶液中,溶液褪色。
②生成的气体通入Br2的CCl4溶液中,溶液褪色。
③用排水法收集一试管气体,点燃,燃烧时火焰明亮,有黑烟产生(甲烷燃烧时火焰为淡蓝色,无烟)。
根据以上现象思考:
A.用其最简单的同系物为例,写出②的反应方程式:___________。
B.碎瓷片的作用是_________________________。
C.产生黑烟的原因是_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com