
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备:
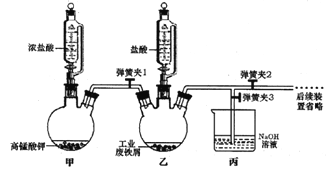
①实验过程中装置乙发生反应的离子方程式有________,仪器丙的作用为_________。
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为_______________。
③反应结束后,将乙中溶液边加入_____________,边进行加热浓缩、______、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
某兴趣小组将饱和FeC13溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeC13溶液浓度越大,水解程度越小 ②氯化铁的熔点为306℃、沸点为315℃ ,易升华,气态FeCl3会分解成FeCl2和Cl2③ FeC12熔点670℃)
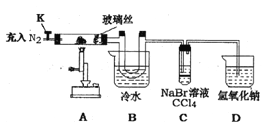
操作步骤 | 实验现象 | 解释原因 |
打开K , 充入氮气 | D中有气泡产生 | ①充入N2的原因________ |
关闭K, 加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________ |
实验结束,振荡C静置 | ③___________ | ④________________(用相关的方程式说明) |
⑤结合以上实验和文献资料,该固体可以确定的成分有______________________。 | ||
【答案】 Fe+2H+=Fe2++H2↑ 、Cl2+2Fe2+=2Fe3++2Cl- 吸收多余的氯气 关闭弹簧夹1和3,打开弹簧夹2;待铁粉完全溶解后打开弹簧夹1和3,关闭弹簧夹2 浓盐酸 冷却结晶 排出装置内的空气 FeC13易升华 溶液分层,上层接近无色,下层橙红色 2FeCl3![]() 2FeCl2+Cl2 、2Br-+Cl2=Br2+2Cl- FeCl3、FeCl2、Fe2O3
2FeCl2+Cl2 、2Br-+Cl2=Br2+2Cl- FeCl3、FeCl2、Fe2O3
【解析】本题考查实验设计方案的评价,(1)①装置甲制取氯气,装置乙发生Fe+2H+=Fe2++H2↑,利用氯气的强氧化性,把Fe2+氧化成Fe3+,离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-;氯气有毒,作为尾气必须除去,除去氯气常用氢氧化钠溶液,因此丙装置中盛放NaOH的作用是除去多余尾气;②为了实验顺利进行,铁和盐酸先充分反应,待铁全部溶解后,再通入氯气,因此操作是:关闭弹簧夹1和3,打开弹簧夹2,待铁粉完全溶解后,打开弹簧夹1和3,关闭弹簧夹2;③Fe3+易水解,为防止水解,边加入浓盐酸,边进行加热浓缩、冷却结晶、过滤;(2)①充入氮气的目的是排除装置中的空气,防止干扰实验;②棕黄色固体是FeCl3,根据信息,FeCl3易升华,A中FeCl3由固体转化成气体,在B装置中遇冷凝结为固体;③FeCl3受热分解成FeCl2和Cl2,Cl2与KBr反应生成Br2,Br2易溶于有机溶剂,现象是:溶液分层,上层接近无色,下层橙红色;④2FeCl3![]() 2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-;⑤根据上述现象和资料推出含有的物质是FeCl3、FeCl2、Fe2O3。
2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-;⑤根据上述现象和资料推出含有的物质是FeCl3、FeCl2、Fe2O3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol/L的NaOH溶液滴定20 mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是

A.X=20
B.HA溶液加水稀释后,溶液中![]() 的值减小
的值减小
C.0.1 mol/L的NaOH溶液中,由水电离出的c(OH)=0.1 mol/L
D.加入NaOH溶液体积为X mL时,溶液中c(A)=0.05 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:

(1)该反应在____min时达到化学平衡状态.
(2)该反应的化学方程式是___________________.
(3)从开始到2min,X的平均反应速率是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸氢铵溶液与少量氢氧化钠溶液:NH![]() +HCO
+HCO![]() +2OH-===NH3·H2O+CO
+2OH-===NH3·H2O+CO![]() +H2O
+H2O
B. 氯化铵溶液中加入少量稀氢氧化钠溶液:NH![]() +OH-===NH3↑+H2O
+OH-===NH3↑+H2O
C. 氨水与盐酸反应:NH3·H2O+H+===NH![]() +H2O
+H2O
D. 氨水中通入过量二氧化碳:2NH3·H2O+CO2===2NH![]() +CO
+CO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是 ( )
A.H2 B.Ag C.Cl2 D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列氮肥的制备反应中,原子利用率最高的是
A. NH3+H2O+CO2=NH4HCO3 B. 2NH3+CO2 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
C. 8NH3+3Cl2=N2+6NH4Cl D. 2NH3+2O2![]() NH4NO3+H2O
NH4NO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与用途具有对应关系的是
A. SO2具有还原性,可用于纸浆的漂白
B. ClO2具有氧化性,可用于水的杀菌消毒
C. SiO2能与强碱反应,可用于制光导纤维
D. MnO2具有氧化性,可与H2O2反应制O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法不正确的是( )
A. 铝热反应可用于冶炼某些金属 B. 聚乙烯和聚氯乙烯可用降解法处理
C. 丁达尔效应可用于区分白酒和淀粉溶液 D. 电渗析法、蒸馏法、离子交换法可用于淡化海水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com