

| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | -57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
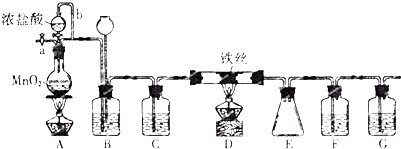
分析 由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,E装置制取氢气,F可防止倒吸,最后氢气还原SiCl4;
(1)装置A是氯气发生装置,A中的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;根据制得的氯气中含有氯化氢和水,装置B用饱和食盐水除去氯化氢,装置C用浓硫酸吸水;
(2)因浓盐酸有挥发性,故分液漏斗要加盖,加盖后如没有g管,则盐酸就不易流下去,g管的作用是平衡压强,使液体顺利流出并防止漏气;
(3)D中氯气与粗硅反应生成SiCl4,h瓶收集粗产物,精馏粗产品可得高纯度四氯化硅,由表中数据可以看出,蒸出SiCl4气体时,BCl3早已成气体被蒸出,而AlCl3、FeCl3、PCl5升华温度均高于SiCl4;
(4)收集产品的导管太细易堵塞导管;制取的四氯化硅需要冷凝;由于尾气中含有氯气,要设置尾气处理装置,四氯化硅易水解,要避免空气中的水蒸气进入产品收集装置;
(5)结合元素守恒,利用氧化还原反应原理书写离子反应方程式,根据关系式5Fe2+~MnO4-计算出100mL溶液中含有的铁,最后求出质量百分数.
解答 解:(1)装置A是氯气发生装置,A中的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,制得的氯气中含有氯化氢和水,装置B用饱和食盐水除去氯化氢,装置C用浓硫酸吸水;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;浓硫酸;
(2)浓盐酸有挥发性,故分液漏斗要加盖,加盖后如没有g管,则盐酸就不易流下去,g管的作用是平衡压强,使液体顺利流出并防止漏气;产物SiCl4沸点低,需要冷凝收集;
故答案为:平衡压强,使液体顺利流出并防止漏气;
(3)D中氯气与粗硅反应生成SiCl4,h瓶收集粗产物,精馏粗产品可得高纯度四氯化硅,由表中数据可以看出,蒸出SiCl4气体时,BCl3早已成气体被蒸出,而AlCl3、FeCl3、PCl5升华温度均高于SiCl4的沸点,所以当SiCl4蒸出后,而AlCl3、FeCl3、PCl5还为固体留在瓶里,除铁元素外可能还含有的杂质元素是Al、P,
故答案为:Al、P;
(4)四氯化硅在常温下易液化,如果收集产品的导管太细易堵塞导管;制取的四氯化硅需要冷凝;由于尾气中含有氯气,要设置尾气处理装置,四氯化硅易水解,要避免空气中的水蒸气进入产品收集装置,在装置Ⅰ的i处接干燥管j,
故答案为:在装置Ⅰ的i处接干燥管j;
(5)用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,MnO4-转变成Mn2+溶液颜色有紫色变成无色,KMnO4标准溶液在酸性条件下进行氧化还原滴定时,不需要指示剂,判断是否达到滴定终点的方法为:当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色,利用关系式法计算:
5Fe2+~MnO4-
4×10-3mol 1.000×10-2mol•L-1×0.02L×$\frac{100}{25}$
铁元素的质量为:4×10-3mol×56g/mol=2.24×10-1g,铁元素的质量分数$\frac{2.24×1{0}^{-1}g}{5.000g}$×100%=4.480%,
故答案为:4.480%.
点评 本题为传统的综合实验方案设计题,综合了氯气的制法、硅的提纯、滴定法等了实验知识,注意滴定食盐的定量计算分析,掌握基础是关键,题目难度增中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢键有方向性和饱和性,属于共价键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 范德华力是一种分子间作用力,也是一种特殊的化学键 | |
| D. | 常温常压下,卤素单质从F2→I2由气态、液态到固态的原因是范德华力逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 碳棒上有气体放出,溶液酸性变弱 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电流从a极到b极 | |
| D. | a极上发生了还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水几乎不导电,因此水是非电解质 | |
| B. | 在任何温度下,纯水的pH均等于7 | |
| C. | 向水中加入钠,溶液中$\frac{{K}_{w}}{c(O{H}^{-})}$减小 | |
| D. | 向水中加入醋酸,c(H+)和水的电离均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO-SO3H)磺化得到.实验室可利用右图装置合成对氨基苯磺酸
| 苯胺 | 对氨基苯磺酸 | |
| 熔点 | -6.3℃ | 288℃ |
| 沸点 | 184℃ | (300℃开始分解炭化) |
| 水溶性 | 微溶于水 | 微溶于冷水、溶于热水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com