
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液(混合液)的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | C | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,仅从甲组情况分析,如何用a (混合液的pH)来说明HA是强酸还是弱酸__________。
(2) 不考虑其它组的实验结果,仅从乙组情况分析,C是否一定等于0.2__________(填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是__________。
(3)丙组实验结果分析,HA是__________酸(填“强”或“弱”)。该组混合液中离子浓度由大到小的顺序是__________。
(4)丁组实验混合液中由水电离出的c(OH-)=__________molL﹣1,写出该混合液中下列算式的精确结果(不需做近似计算)。
c(Na+)-c(A-)=__________molL-1, c(OH-)-c(HA)=__________molL-1。
【答案】a=7为强酸,a>7为弱酸; 否 c(A-)=c(Na+) 弱 c(Na+)>c(A-)>c(OH-)>c(H+) 10﹣5 10﹣5﹣10﹣9 10﹣9
【解析】
(1)酸碱的物质的量相等,如为强酸,反应后溶液呈中性,如为弱酸,反应后溶液呈酸性;
(2)从溶液电中性的角度分析;
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸;
(4)等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,水电离出的氢离子等于水电离出的氢氧根离子,根据电荷守恒计算。
(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,
故答案为:a=7,HA是强酸;a>7,HA是弱酸。
(2)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A-)+c(OH-),所以c(A-)=c(Na+),
故答案为:否,=。
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,在溶液中存在A-+H2O![]() HA+OH-,则c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
HA+OH-,则c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱,c(Na+)>c(A-)>c(OH-)>c(H+)。
(4)丁组实验所得混合溶液为浓度为0.5mol/L的NaA溶液,其pH=9,则氢离子浓度为10-9mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=Kw/c(H+)=10-14/10-9mol/L=10-5mol/L,即水电离出的氢氧根离子浓度为10-5mol/L,根据电荷守恒得:c(Na+)+c(H+)=c(A-)+c(OH-),所以c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol/L,由物料守恒可知,c(A-)+c(HA)=c(Na+),c(Na+)-c(A-)=c(OH-)-c(H+)=c(HA),则c(OH-)-c(HA)=c(H+)=10-9mol/L,
故答案为:10-5,10-5-10-9,10-9。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。

(1)在元素周期表中全部是金属元素的区域为____________(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________,写出其中含有非极性共价键的化合物的电子式_______________。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①写出甲元素周期表中对应的位置__________。
②甲、乙两元素中,金属性较强的是__________(填元素名称),可以验证该结论的实验是_______________(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,分别进行不同条件下的合成氨反应N2(g)+3H2(g)![]() 2NH3(g)。在相同时间内表示该反应速率最快的是
2NH3(g)。在相同时间内表示该反应速率最快的是
A. v(H2)=0.1mol/(Ls) B. v(N2)=0.1mol/(Ls) C. v(N2)=0.2mol/(Ls) D. v(NH3)=0.3mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
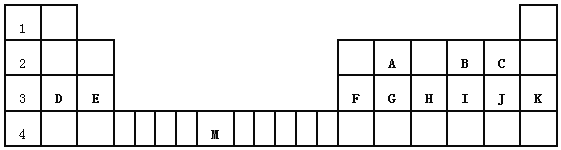
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
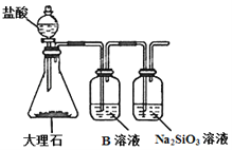
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:
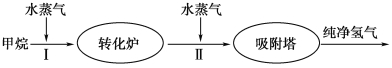
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)此流程的第Ⅱ步反应CO(g)+H2O(g) ![]() H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是________(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v(CO2正)=v(H2O逆)
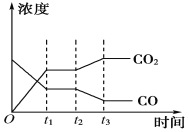
(4)下图表示此流程的第Ⅱ步反应在t1时刻达到平衡,在t2时刻分别因改变某个条件而发生变化的情况:图中t2时刻发生改变的条件可能是________________________(写出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺流程如下:
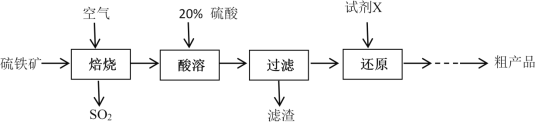
回答下列问题:
(1)焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____________________
(2)试剂X是(写化学式)__________________
(3)设计实验检验还原得到的溶液是否达标:_________________________________________
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是_______________________
(5)可以用标准浓度的酸性KMnO4溶液来测定产品中FeSO4的纯度,反应中KMnO4被还原成Mn2+。反应的离子方程式为 __________________________________
(6)某种工业品中含有FeSO4和Fe2(SO4)3。通过元素分析得知其中铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2 ,此工业品中FeSO4的物质的量分数为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1.00mol NaCl中含有6.02×1023个NaCl分子
B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C. 欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D. 电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 红棕色的NO2加压后颜色先变深后变浅 B. 温度过高对合成氨不利
C. 钢铁在潮湿的空气中容易生锈 D. 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
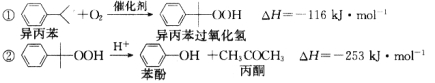
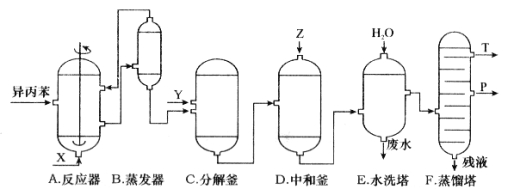
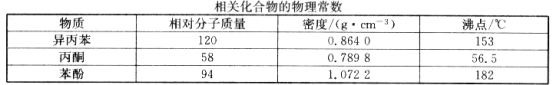
回答下列问题:
(1)在反应器 A 中通入的 X 是 。
(2)反应①和②分别在装置 和 中进行。(填装置符号)
(3)在分解釜 C中加入的Y为少量浓硫酸,其作用是 ,优点是用量少,缺点是 。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度应控制在 50~60℃,温度过高的安全隐患是 。
(5)中和釜 D 中加入的 Z 最适宜的是 (填序号。已知苯酚是一种弱酸)。
A.NaOH B.CaCO3 C.NaHCO3 D.CaO
(6)蒸馏塔 F 中的馏出物 T 和 P 分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com