
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺流程如下:
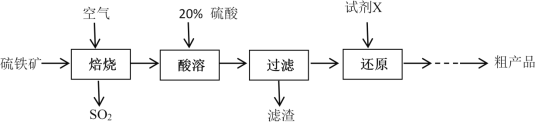
回答下列问题:
(1)焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____________________
(2)试剂X是(写化学式)__________________
(3)设计实验检验还原得到的溶液是否达标:_________________________________________
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是_______________________
(5)可以用标准浓度的酸性KMnO4溶液来测定产品中FeSO4的纯度,反应中KMnO4被还原成Mn2+。反应的离子方程式为 __________________________________
(6)某种工业品中含有FeSO4和Fe2(SO4)3。通过元素分析得知其中铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2 ,此工业品中FeSO4的物质的量分数为___________________________
【答案】4FeS2 + 11O2 ![]() 2Fe2O3 + 8SO2 Fe 取少量溶液于试管中,滴加KSCN溶液,如果溶液不显红色,证明溶液达标 蒸发浓缩、冷却结晶、过滤 MnO4- + 5Fe2+ +8 H+ = Mn2+ + 5Fe3++ 4H2O 3/4 (75%)
2Fe2O3 + 8SO2 Fe 取少量溶液于试管中,滴加KSCN溶液,如果溶液不显红色,证明溶液达标 蒸发浓缩、冷却结晶、过滤 MnO4- + 5Fe2+ +8 H+ = Mn2+ + 5Fe3++ 4H2O 3/4 (75%)
【解析】
硫铁矿通入空气焙烧得到氧化铁和二氧化硫,固体物质加入20%硫酸酸溶后过滤后得到溶液为硫酸铁溶液,硫酸铁中加入铁粉得到硫酸亚铁溶液,经蒸发浓缩、冷却结晶得到硫酸亚铁晶体,据此答题。
(1)硫铁矿高温焙烧反应生成氧化铁和二氧化硫,原子守恒配平书写化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2,故答案为:4FeS2+11O2
2Fe2O3+8SO2,故答案为:4FeS2+11O2![]() 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(2)由分析可知,加入的试剂X是铁,铁与硫酸铁反应生成硫酸亚铁,故答案为:Fe。
(3)检验还原得到的溶液是否达标就是看溶液中是否含有铁离子,用KSCN溶液检验是否含有Fe3+,具体操作为:取少量溶液于试管中,滴加KSCN溶液,如果溶液不显红色,证明溶液达标,故答案为:取少量溶液于试管中,滴加KSCN溶液,如果溶液不显红色,证明溶液达标。
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是蒸发浓缩、冷却结晶、过滤,故答案为:蒸发浓缩、冷却结晶、过滤。
(5)高锰酸钾在酸性溶液中具有强氧化性能氧化亚铁离子为铁离子,本身被还原为二价锰离子,铁元素的化合价由+2价升高为+3价,锰元素的化合价由+7价降低为+2价,根据电荷守恒和原子守恒,反应的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(6)设某种工业品中含有FeSO4的物质的量为xmol,Fe2(SO4)3的物质的量为ymol,根据铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2可知,(x+2y):(x+3y)=1:1.2,解得x:y=3:1,所以FeSO4的物质的量分数为3/(3+1)×100%=75%,故答案为:3/4(75%)。


科目:高中化学 来源: 题型:
【题目】用下图装置进行浓硫酸和木炭反应的实验,并检验有CO2和SO2两种气体生成。

回答下列问题:
(1)仪器a的名称为_________,A装置中反生反应的化学方程式为___________________________________________。
(2)虚线框内有一处错误,请指出______________________,
装置B的作用是___________________________________________。
(3)装置C中酸性KMnO4溶液用于除去SO2,其目的是________。(填序号)
甲:防止SO2干扰CO2的检验 乙:吸收CO2气体 丙:检验SO2
(4)装置E的现象是_______________________________,E中发生反应的离子方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.氯气是黄绿色、有刺激性气味、有毒的气体
B.三氧化二铝是两性氧化物
C.晶体硅用来制作光导纤维
D.焰色反应是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学电化学知识,回答有关问题。
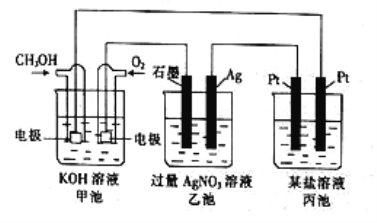
(1)图中甲池是____(填“原电池”或“电解池”)装置,其中OH-移向___(填“正”或“负”)极。
(2)通入CH3OH一端的电极反应式为_____________________。
(3)反应一段时间后,甲池中消耗560mL(标准状况)O2,此时乙池溶液的pH=______(设此时乙池中溶液的体积为100mL)。
(4)当乙池中Ag电极的质量增加5.4g时,丙池中某电极析出1.6g某金属,则丙池中的某盐可能是__________(填字母)。
A.MgSO4 B.CuCl2 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学欲利用CuO与NH3的反应来研究NH3的某种性质并测定其组成,设计的实验装置如图所示(夹持装置已省略)。
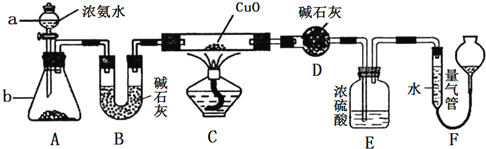
请回答下列问题:
(1)仪器a的名称为______________;仪器b中盛装的试剂为__________________(填名称)。
(2)实验中观察到装置C中黑色CuO粉末变为单质铜,且量气管中有气体单质产生,上述实验现象证明NH3具有____________性,写出相应的化学方程式:_________________________。
(3)装置E中浓硫酸的作用是_________________________________。
(4)实验结束后,若测得干燥管D增重mg,装置F中气体的体积为nL(已折算为标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所构成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是
A. 1.8 g 18O2的物质的量是0.05 mol
B. 0.1 mol H218O中所含的中子数约为6.02×1023
C. 0.2 mol 18O2的体积约为4.48 L
D. 18O2的摩尔质量为36 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(俗名)、化学式都正确的是( )
A.碱性氧化物 氧化铁 FeOB.酸 硫酸 H2S
C.酸性氧化物 干冰 CO2(固态)D.盐 石膏 2CaSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 酸性食物就是吃的时候感觉有酸味的物质
B. 铁元素和碘元素都是人体必需的微量元素
C. 油脂是能量最高的食物,所以要多吃油脂类食物保证体内能量需求
D. 糖尿病人不能多吃甜食,可以多食用淀粉类的食物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com