
【题目】根据所学电化学知识,回答有关问题。
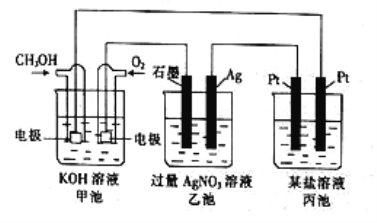
(1)图中甲池是____(填“原电池”或“电解池”)装置,其中OH-移向___(填“正”或“负”)极。
(2)通入CH3OH一端的电极反应式为_____________________。
(3)反应一段时间后,甲池中消耗560mL(标准状况)O2,此时乙池溶液的pH=______(设此时乙池中溶液的体积为100mL)。
(4)当乙池中Ag电极的质量增加5.4g时,丙池中某电极析出1.6g某金属,则丙池中的某盐可能是__________(填字母)。
A.MgSO4 B.CuCl2 C.NaCl D.AgNO3
【答案】 原电池 负 CH3OH-6e-+8OH-==CO32-+6H2O 0 BD
【解析】分析:(1)甲池是能自发的进行氧化还原反应,属于原电池,据此解答;
(2)燃料电池的负极上是燃料发生失电子的氧化反应;
(3)根据电子守恒来计算;
(4)根据电解池的工作原理结合电子守恒来计算即可。
详解:(1)图中甲池能自发进行氧化还原反应,属于原电池中的燃料电池;原电池中阳离子向正极移向,阴离子向负极移动。通入甲醇的电极是负极,因此OH-移向负极;
(2)通入CH3OH的电极是燃料电池的负极,发生失电子的氧化反应,电解质溶液显碱性,则负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
(3)标准状况下560mL氧气的物质的量是0.56L÷22.4L/mol=0.025mol,转移0.025mol×4=0.1mol电子。电解池中连接原电池负极的电极为阴极、连接原电池正极的电极为阳极,因此石墨是阳极,银电极是阴极,电解硝酸银溶液的方程式为4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,即产生4mol硝酸,转移4mol电子,所以反应中生成0.1mol硝酸,物质的量浓度是0.1mol÷0.1L=1.0mol/L,则此时乙池溶液的pH=0。
4Ag+4HNO3+O2↑,即产生4mol硝酸,转移4mol电子,所以反应中生成0.1mol硝酸,物质的量浓度是0.1mol÷0.1L=1.0mol/L,则此时乙池溶液的pH=0。
(4)根据电解池的工作原理,电解硝酸银溶液的反应为4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,当乙池中Ag极质量增加5.4g,根据电极反应Ag++e-=Ag,生成0.05mol银,转移电子是0.05mol,此时丙池中某电极析出1.6g某金属,则该金属是铜(氯化铜恰好反应或过量),也可以是析出金属银的情况(硝酸银不足),镁离子和钠离子在水溶液中不会放电,答案选BD。
4Ag+4HNO3+O2↑,当乙池中Ag极质量增加5.4g,根据电极反应Ag++e-=Ag,生成0.05mol银,转移电子是0.05mol,此时丙池中某电极析出1.6g某金属,则该金属是铜(氯化铜恰好反应或过量),也可以是析出金属银的情况(硝酸银不足),镁离子和钠离子在水溶液中不会放电,答案选BD。


科目:高中化学 来源: 题型:
【题目】分子式为C9H8O2Br2的有机化合物M,在一定条件下可发生下述一系列反应:
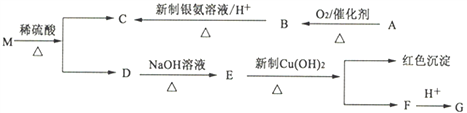
已知:①两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:

②有机物A的相对分子质量为46,有机物G遇FeC13溶液显色,核磁共振氢谱有4个峰。
回答下列问题:
(1)B→C的反应类型是____________。
(2)M的结构简式为_________________________________________________。
(3)写出下列反应的化学方程式:
①A→B:________________________________________________________;
②D→E:________________________________________________________;
③E→F:________________________________________________________。
(4)与G互为同分异构体,苯环上有两个取代基,且遇FeC13溶液显色的物质有_________种(不包含G)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向溶液M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断不正确的是(不计CO2溶解)

A. 若OB=0,则形成溶液的过程中所发生反应的离子方程式为OH―+CO2═HCO3―
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32―和HCO3―
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,几种物质的pH和浓度如下表所示。
序号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
浓度 | c1 | c2 | c3 | c4 |
回答下列问题:
(1) c1_____(填“>”“<”或“=”) c2。
(2)溶液中水的电离程度②_____(填“>”“<”或“=”)③。
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为________(填序号)。
(4) ①溶液与④溶液等体积混合,溶液的pH_______(填“>"'<"或“=”,下同)7,混合溶液中c(NH4+)____c(Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺流程如下:
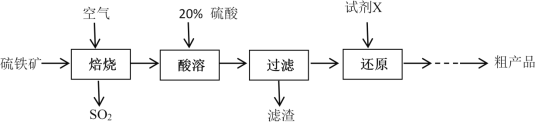
回答下列问题:
(1)焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____________________
(2)试剂X是(写化学式)__________________
(3)设计实验检验还原得到的溶液是否达标:_________________________________________
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是_______________________
(5)可以用标准浓度的酸性KMnO4溶液来测定产品中FeSO4的纯度,反应中KMnO4被还原成Mn2+。反应的离子方程式为 __________________________________
(6)某种工业品中含有FeSO4和Fe2(SO4)3。通过元素分析得知其中铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2 ,此工业品中FeSO4的物质的量分数为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语不正确的是( )
A. 质子数为8、中子数为10的氧原子:![]()
B. 比例模型![]() , 不能表示二氧化碳,可以表示水分子
, 不能表示二氧化碳,可以表示水分子
C. 碳正离子(CH3+)的电子式为 ![]()
D. 氨气溶于水使溶液呈碱性:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、材料、信息、能源关系密切。下列说法错误的是( )
A.计算机芯片的材料是二氧化硅
B.购物时用布袋代替塑料袋
C.减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量
D.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )
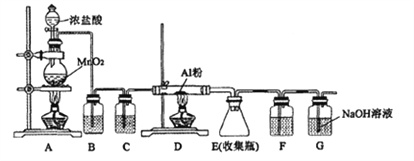
A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com