
【题目】下列装置能达到实验目的是( )
A. 配置溶液时转移溶液
B. 石油蒸馏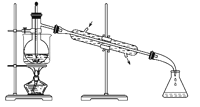
C. 观察钾的焰色反应
D. 比较NaHCO3和Na2CO3热稳定性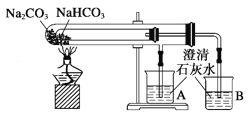
【答案】D
【解析】
A. 转移液体时,需用玻璃棒引流;
B. 蒸馏操作时,温度计测的是蒸汽的温度;冷凝水应该“下进上出”;
C. 要透过蓝色钴玻璃观察火焰颜色;
D. 根据碳酸氢钠的稳定性比碳酸钠的稳定性差作答。
A. 配制一定浓度的溶液时在转移操作中,需用玻璃棒引流,则图示一操作不规范,不能达到实验目的,故A项错误;
B. 石油蒸馏操作过程中,温度计应放在蒸馏烧瓶的支管口处,且为保证冷凝管中水的进出方向也反了,图示二操作不规范,故B项错误;
C. 钠元素的焰色为黄色,因该黄色会屏蔽紫色,使人无法观察出紫色,所以在观察钾的焰色反应时,为防止可能的黄色干扰实验的进行,需透过蓝色钴玻璃,滤去黄光以后进行观察,故C项错误;
D. 碳酸氢钠不稳定,受热易分解,碳酸钠较稳定,受热不易分解,所以加热时碳酸钠受热温度应该高于碳酸氢钠,操作科学规范,故D项正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】物质的分类有多种方法,下列对无机化合物分类如图:

(1)如图所示的物质分类方法的名称是________。
(2)以元素 Na、Ba、H、O、S、N 中任意两种或三种元素组成合适的物质,将化学式分别填在下表中④、⑥的后面________、__________

(3)⑦和⑧的水溶液可导电,它们________(填“是”或“不是”)电解质;相同质量的两气体所含氧原子的个数比为________;标准状况下等体积两气体的质量比为________。
(4)少量⑧与足量④的溶液反应的离子方程式为________。
(5)写出⑦与⑨反应的化学方程式________。
(6)写出工业制造硝酸过程中⑩NH3 与氧气反应的化学方程式为________,若 16g 氧气全部被还原,则转移电子________mol。
(7)现有由①与②混合的稀溶液 100mL,其中①的物质的量浓度为 2.0mol·L-1,②的物质的量浓度为 1.0mol·L-1。则该溶液能溶解铜的最大质量为________g,同时,反应生成的气体在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B. pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D. 0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室的硫酸试剂标签上的部分内容。据此,下列说法正确的是

A. 该硫酸的物质的量浓度为9.2mol·L-1
B. 1mol Fe与足量的稀硫酸反应,标准状况下产生44.8L气体
C. 若实验室需要4.6 mol/L的稀硫酸500mL,配制稀硫酸时则应量取该硫酸125.0mL
D. 该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H8O2Br2的有机化合物M,在一定条件下可发生下述一系列反应:
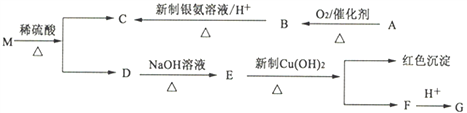
已知:①两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:

②有机物A的相对分子质量为46,有机物G遇FeC13溶液显色,核磁共振氢谱有4个峰。
回答下列问题:
(1)B→C的反应类型是____________。
(2)M的结构简式为_________________________________________________。
(3)写出下列反应的化学方程式:
①A→B:________________________________________________________;
②D→E:________________________________________________________;
③E→F:________________________________________________________。
(4)与G互为同分异构体,苯环上有两个取代基,且遇FeC13溶液显色的物质有_________种(不包含G)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中只可能含有H+、Na+、NH4+、Cu2+、Al3+、Ag+、Fe3+、CO32-、NO3-、SO42-中的一种成几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
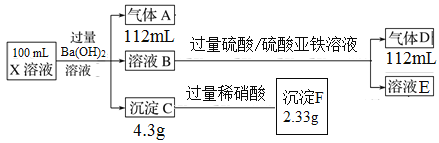
(1)X溶液中一定不存在的离子是________。
(2)加入过量H2SO4/FeSO4溶液时,发生反应的离子方程式为________。
(3)X溶液中c(CO32-)=_____mol/L,c(Na+)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据金属活动性顺序表,Cu不能发生:Cu+2H2O=Cu(OH)2↓+H2↑的反应。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的是
A | B | C | D | |
阳极 | 石墨棒 | Cu | Cu | Cu |
阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
电解液 | CuSO4溶液 | Na2SO4溶液 | H2SO4溶液 | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是

A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+) > c(OH-) > c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺流程如下:
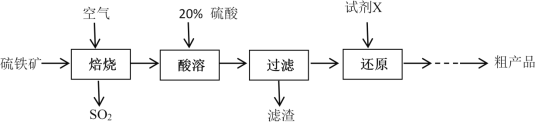
回答下列问题:
(1)焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____________________
(2)试剂X是(写化学式)__________________
(3)设计实验检验还原得到的溶液是否达标:_________________________________________
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是_______________________
(5)可以用标准浓度的酸性KMnO4溶液来测定产品中FeSO4的纯度,反应中KMnO4被还原成Mn2+。反应的离子方程式为 __________________________________
(6)某种工业品中含有FeSO4和Fe2(SO4)3。通过元素分析得知其中铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2 ,此工业品中FeSO4的物质的量分数为___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com