
(1)该混合气体由哪些气体混合而成?各占多少毫升?
(2)最后剩余20 mL是什么气体?简要说明理由。
解析:混合气体通过浓H2SO4,体积减少30 mL,即V(NH3)=30 mL,由NH3的存在知不可能有HCl气体,则剩余气体为CO2和NO体积为100 mL-30 mL=70 mL
设CO2体积为x,则NO为(70 mL-x),
由反应方程式:2CO2+2Na2O2====2Na2CO3+O2可知生成的O2体积为![]() 。
。
①若氧气过量
2NO + O2 ==== 2NO2
2 1 2
70 mL-x ![]() 70 mL-x
70 mL-x
![]()
解之,不合理。
②若NO过量,依题意有
2NO+O2====2NO2
2 1 2
x ![]() x
x
(70 mL-x)-x+x=40 mL
所以x=30 mL
即V(CO2)=30 mL
V(NO)=70 mL-30 mL=40 mL
由上可知NO过量了10 mL,生成了30 mL NO2,经过水后,最后剩余的20 mL气体为NO,因为由
3NO2+H2O====2HNO3+NO
30 10
生成了10 mL NO,加上过量的10 mL,共20 mL NO。
答案:(1)混合气体由NH3、CO2、NO组成,其中V(NH3)=30 mL,
V(CO2)=30 mL,V(NO)=40 mL。
(2)最后剩余的20 mL气体为NO。


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:

| 500aρ |
| 49a+b |
| 500aρ |
| 49a+b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含____________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含______________所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
方案1 |
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1—2滴溴水,溶液呈黄色所发生的离子反应方程式为____________________________________________。
②在100 mL FeBr2溶液中通入2.24 LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____________。
Ⅱ.某校化学实验兴趣小组为“证明某水煤气中CO2、CO、H2、H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰)
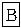
(1)该小组证明CO2存在应选用____________装置,现象是:_______________________。证明H2O(气)的存在应选用_____________装置,现象是______________________________。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:混合气体—( )—( )—( B)—( )—( )—( )。
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(A)“物质结构与性质”课程模块
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是___________ (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是________;③和⑦形成的常见化合物的化学键类型是___________。
(3)元素⑧的外围电子排布式为___________,该元素原子中未成对电子数为___________。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_________________________________________________。
(5)在1 183 K以下,元素⑨形成如图甲所示基本结构单元的晶体;1 183 K以上,转变为图乙所示基本结构单元的晶体。

在1 183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为___________;在1 183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为___________。
(B)“实验化学”课程模块
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:

氧化型(蓝色)+ne-![]() 还原型(无色)。
还原型(无色)。
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图甲。
某校化学兴趣小组用图甲装置进行下述实验:
①在250 mL锥形瓶中,依次加入
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③④可重复多次。
请回答下列问题:
(1)若塞紧图甲中锥形瓶塞,并打开导管活塞a、b,从___________(填“左”或“右”)导管口通入足量氦气后,再关闭活塞a、b并振荡,溶液__________(填“能”或“不能”)由无色变为蓝色。
(2)如图乙所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是___________试管。
(3)上述转化过程中葡萄糖的作用是_______________,亚甲基蓝的作用是______________。
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为______________。
(5)该实验中③④操作___________(填“能”或“不能”)无限次重复进行,理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:氧化型(蓝色)+ne-![]() 还原型(无色),奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。
还原型(无色),奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。
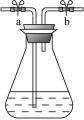
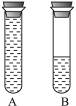
图1 图2
某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2 g NaOH、100 mL H2O和2 g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从____________导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液_________(填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是_________试管。
(3)上述转化过程中葡萄糖的作用是_________,亚甲基蓝的作用是_________。
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为____________________________________。
(5)该实验中③④操作_________(填“能”或“不能”)无限次重复进行,理由是______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省盟校十校联考高三第一次联考理综化学试卷(解析版) 题型:实验题
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:

已知:
名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
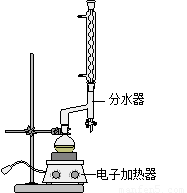
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是????????? (填入正确选项前的字母)。
A.25 mL?? ?? B.50 mL? ?? ? C.100 mL? ?? ? D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是????????????????????? 。
(3)步骤②中应控制馏分的温度在???????????? 。
A.65~70℃???????? B.78~80℃????? C.85~90℃????? D.215~220℃
(4)步骤③加入Na2CO3的作用是?????????????????????? ;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是????????????????????????????????????? ?? 。
(5)关于步骤③中的萃取分液操作叙述正确的是??????????
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为??????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com