
【题目】下列四种X溶液,均能跟盐酸反应,其中反应最快的是
A.10℃ 20mL 3mol/L的X溶液 B.20℃ 30mL 2molL的X溶液
C.20℃ 10mL 4mol/L的X溶液 D.10℃ 10mL 2mol/L的X溶液
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,Y的体积分数与时间关系如图II所示.则下列结论正确的是
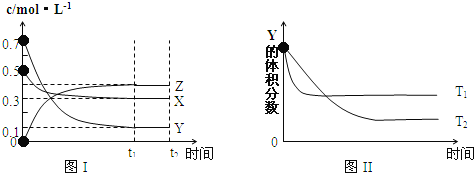
A. 该反应的热化学方程式为:X(g)+3Y(g)![]() 2Z(g);△H>0
2Z(g);△H>0
B. 若其它条件不变,升高温度,正、逆反应速率均增大,X的转化率减小
C. 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A. 中子数为20的氯原子: ![]() Cl B. 硫离子的结构示意图:
Cl B. 硫离子的结构示意图:
C. N2H4的电子式:![]() D. 丙烯的结构简式:CH2CHCH3
D. 丙烯的结构简式:CH2CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E,F,G七种元素,试按下述所给的条件推断: ①A,B,C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素.
(1)A的名称是 , B位于周期表中第周期族,C的原子结构示意图是 .
(2)E的单质颜色是 .
(3)A元素与D元素形成化合物的电子式是 .
(4)G的单质与水反应的化学方程式是 .
(5)F的元素符号是 .
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 , 酸性最强的化学式是 , 气态氢化物最稳定的化学式是 .
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于干电池的描述错误的是
A. 最早的干电池是锌锰电池
B. 普通干电池可以多次充电反复使用
C. 普通锌锰干电池在使用过程中外壳逐渐变薄是因为:Zn-2e-=Zn2+
D. 普通干电池是一种将电能转变成化学能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:

(1) “酸浸”需要加热的目的是__________,此过程中发生反应的离子方程式是______________。(任写一条)
(2) “熔融”过程中,MnO2被KC1O3氧化成K2MnO4。
①该反应的化学方程式为_____________________。
②加入KC1O3应过量的原因除了提高MnO2利用率,还有_________________.
③将适量KClO3和KOH混合均匀后在坩埚内高温反应,应选用坩埚为__________。(选填序号)
a.石英坩埚 b.铁坩埚 c.氧化铝坩埚
(3)己知:①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如下图。

请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2,_____________,低温供干得KMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
(2)表中能形成两性氢氧化物的元素是(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 .
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:

(1) Na2MoO4·2H2O中钼元素的化合价是_________。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是_________________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 gMoO3,反应中,转移电子的数目为____________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______________(填序号)。
a.Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_____________________。
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com