
【题目】洁厕灵和84消毒液混合使用会发生反应:![]() ,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是
,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是
A.每生成![]() 氯气,转移的电子数为2NA
氯气,转移的电子数为2NA
B.![]() 含有的电子数为28NA
含有的电子数为28NA
C.![]() 溶液中含有的次氯酸根离子数为0.2NA
溶液中含有的次氯酸根离子数为0.2NA
D.将分子总数为NA的![]() 和
和![]() 的混合气体置于标准状况下,其体积约为
的混合气体置于标准状况下,其体积约为![]()
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
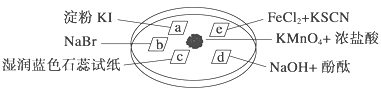
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是还原性弱酸,常用于橡胶、医药等工业生产,也可用于制备重要的化工原料[Cu(HCOO)2·4H2O]。
I.碱式碳酸铜的制备
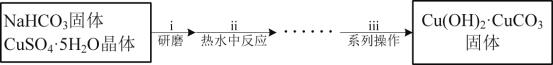
(1)“操作i”中研磨的目的是__。
(2)“操作ii”发生的反应是:2CuSO4+4NaHCO3═Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O。原料中NaHCO3必须过量的原因是__。反应温度低于80℃的原因是__。
(3)“操作iii”中系列操作包括过滤、__、干燥。
II.甲酸的制备
(4)一定条件下,CO能与NaOH固体发生反应:CO+NaOH![]() HCOONa,再将HCOONa酸化,即可得HCOOH。
HCOONa,再将HCOONa酸化,即可得HCOOH。
①为了证明“CO与NaOH固体发生了反应”,甲同学设计下列验证方案:取少许固体产物,配成溶液,在常温下测其pH,若pH>7,则得证。该方案是否可行__(填“是”或“否”),请简述你的理由:__。
②乙同学设计了另一个定性验证方案:取固体产物,配成溶液,__(请补充完整)。
III.甲酸铜的合成及纯度测定
(5)实验室按Cu(OH)2·CuCO3+4HCOOH+5H2O═2Cu(HCOO)2·4H2O+CO2↑反应制得甲酸铜晶体,按以下步骤测定其纯度。
步骤一:准确称取mg甲酸铜晶体样品,配成250mL溶液;
步骤二:移取25.00mL溶液于锥形瓶中,往溶液中加入足量KI摇匀,用cmol/LNa2S2O3溶液滴定至溶液变浅黄色时,加入10mL10%KSCN试剂,并加几滴淀粉溶液,继续用cmol/LNa2S2O3溶液滴定至终点,共消耗Na2S2O3溶液V1mL。
步骤三:用25.00mL蒸馏水代替甲酸铜溶液,重复步骤二,消耗Na2S2O3溶液V2mL;
已知:CuI难溶于水,能吸附I2;2Cu2++4I-=2CuI↓+I2;I2+2![]() =
=![]() +2I-;CuI(s)+SCN-(aq)
+2I-;CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①配制溶液时用到的玻璃仪器有:烧杯、量筒、玻璃棒和__;
②实验中加入10mL10%KSCN试剂的目的是__。
③甲酸铜晶体的纯度__(列表达式即可,Cu(HCOO)2·4H2O的摩尔质量为226g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
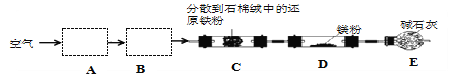
下列说法正确的是( )
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 若去掉装置 C,对产品纯度无影响
C. 实验时应先加热 C,通入一段时间空气后再加热D
D. E 中碱石灰的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(变式探究)在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有a/4 g HNO3被还原,则a∶b不可能为 ( )
A. 2∶1 B. 3∶1 C. 4∶1 D. 9∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水中,最后无气体剩余,则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
【答案】B
【解析】
铁与硝酸反应生成Fe2+、Fe3+和氮的氧化物,氮的氧化物与一定量的O2混合后通入水中,最后无气体剩余,说明氮的氧化物与O2完全反应生成硝酸,铁还原硝酸的量与生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同,据此计算。
由题意可知,铁还原硝酸的量与氮的氧化物与O2完全反应生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同。11.2gFe的物质的量为0.2mol,Fe全部溶解,生成Fe2+和Fe3+的物质的量之比为1:4,所Fe2+的物质的量为0.04mol,Fe3+的物质的量为0.16mol,共失去电子为0.04mol×2+0.16mol×3=0.56mol,由得失电子守恒,O2得到电子的物质的量为0.56mol,所以O2的物质的量为0.56mol/4=0.14mol,故选B。
【点睛】
本题考查铁和硝酸反应的有关计算,该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
【题型】单选题
【结束】
23
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。试写出:
(1)a粒子的原子结构示意图是______________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,实验室制备d气体的化学方程式为________;若d为正四面体形分子,其重要应用之一为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质的叙述正确的是( )
A.SiO2与浓盐酸在高温下能反应生成SiCl4
B.木炭与浓硫酸共热可生成CO2
C.明矾溶液中加入过量NaOH溶液可制备Al(OH)3胶体
D.向饱和食盐水中通入足量CO2可制得NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )
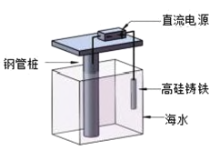
A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com