
【题目】车用妄全气囊中反应方程式为NaN3=2Na+3N2↑,用双桥线标出电子转移的数目和变化类型,指出氧化剂和还原剂。若要得到标准状况下33.6 LN2,需要多少克NaN3(写出计算过程),NaN3的密度约为2 g/cm3,则NaN3的体积约为多少立方厘米。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H202相似,熔点为l93 K,沸点为41lK,遇水很容易水解,产生的气体能使品红褪色,S2C12可由干燥的氯气通入熔融的硫中制得。下列有关说法正确的是( )
A.S2C12晶体中存在离子键和非极性共价键
B.S2C12分子中各原子均达到8电子稳定结构
C.S2C12在熔融状态下能导电
D.S2C12与水反应后生成的气体难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H—H键断裂;
②一个N≡N键断裂的同时,有2个N—H键断裂;
③N2、H2、NH3浓度比为1:3:2
④保持其它条件不变时,体系压强不再改变;
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变;
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.②⑤⑥ B.①④⑤ C.④⑤⑦ D.③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1HNMR谱显示两者均有三种不同化学环境的氢原子且三种氢原子的比例相同,故不能用1HNMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个气态物质之间的反应:C2H2(g)+H2(g)![]() C2H4(g) ①
C2H4(g) ①
2CH4(g)![]() C2H4(g)+2H2(g) ②
C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)=CH4(g) ΔH=-Q1 I
2C(s)+H2(g)=C2H2(g) ΔH=-Q2 II
2C(s)+2H2(g)=C2H4(g) ΔH=-Q3 III
Q值大小比较正确的是
A.Q1>Q3>Q2 B.Q1>Q2>Q3 C.Q2>Q1>Q3 D.Q3>Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X元素在周期表中的位置为 ,表中元素原子半径最小的是_________(填元素名称)。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a. Y单质与H2S溶液反应,溶液变浑浊
b. 在氧化还原反应中,1molY单质比1molS得电子多
c. Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为 。
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是 。
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式 ,该化合物中的化学键类型有 。
(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题:
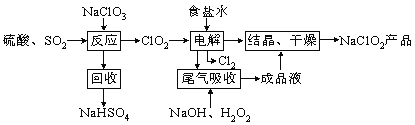
(1)ClO2的沸点为283K,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全。写出“反应”步骤中生成ClO2的化学方程式 。
(2)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
①在尾气吸收过程中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
②提高尾气的吸收效率的可行措施有 (填序号)。
A.尾气吸收时充分搅拌吸收液 B.适当加快尾气的通入速率
C.将温度控制在20℃以下 D.加水稀释尾气吸收液
③此吸收反应中,氧化剂与还原剂的物质的量之比为 。
(3)在碱性溶液中NaClO2比较稳定,在酸性溶液中,ClO2-和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式: 。
(4)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2,在NaClO2析出过程中可能混有的杂质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用斐林试剂检测还原糖时,其溶液的颜色变化过程为
A. 浅蓝色→无色→棕色 B. 浅蓝色→棕色→砖红色
C. 棕色→浅蓝色→砖红色 D. 棕色→砖红色→绿色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com