
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是( )
)是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是( )
A.与环戊烯互为同分异构体B.所有碳原子不可能处于同一平面
C.二氯代物有3种D.生成1 molC5H12至少需要2 molH2
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】I.布朗斯特(Brnsted)和劳莱(Lowry)的质子理论认为,凡是给出质子(H+)的任何物质(分子或离子)都是酸;凡是接受质子(H+)的任何物质都是碱。简单地说,酸是质子的给予体,而碱是质子的接受体。酸和碱之间的关系表示如:酸![]() 质子(H+)+ 碱
质子(H+)+ 碱
(1)根据酸碱质子理论,既能看成酸又能看成碱的是_____________。(均填序号)
①![]() ②HS- ③
②HS- ③![]() ④H2O ⑤H3O+ ⑥Na+
④H2O ⑤H3O+ ⑥Na+
(2)已知反应C6H5OH + ![]() =C6H5O - +
=C6H5O - +![]() ,则C6H5O – 和
,则C6H5O – 和![]() -碱性较强的是__________。
-碱性较强的是__________。
Ⅱ.(3)水的离子积常数为Kw ,弱酸HA的电离平衡常数为Ka,NaA的溶液中A-的水解平衡常数为Kh ,根据它们的平衡常数表达式判断,Ka与Kh的关系为__________________。
(4)已知常温下弱酸HA的电离平衡常数为K=1.75× 10-5,常温下向0.2mol/L的HA的溶液中加入等体积0.1mol/L的NaOH溶液,该溶液pH值___7(填“>”或 “=”或 “<”),该溶液粒子浓度关系正确的是____。
A.2c(Na+)> c(HA)+c(A-)
B.c(A-)—c(HA)=2[c(H+)—c(OH-)]
C.c(A-)> c(Na+)> c(HA)> c(H+)>c(OH-)
D.c(Na+)>c(A-)> c(HA)>c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
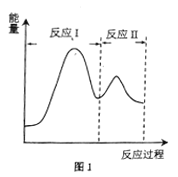
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中不正确的是
A. 某密闭容器中盛有0.2 mol SO2和0.1 mol O2,一定条件下充分反应,生成SO3分子数小于0.2 NA
B. 一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1 NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为 0.1 NA
D. 20g D2O中含有的质子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.有化学键断裂的过程一定发生化学变化
B.氯化钠是一种电解质,电解饱和食盐水可制得金属钠
C.将pH=a的醋酸稀释为pH=a + 1的过程中,c(CH3COOH)/c(H+)减小
D.SiO2是酸性氧化物,能与强碱溶液反应,但不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.Na+、Fe2+、Cl–、NO3–等离子能在甲基橙试液显红色的溶液中共存
B.K+、Mg2+、Cl–、I–等离子能在[H+] = 10–12 mol·L–1的溶液中共存
C.NaHS水解的离子方程式为:HS–+H2O ![]() S2–+H3O+
S2–+H3O+
D.NaHCO3的电离方程式为:NaHCO3=Na++HCO3–,HCO3– ![]() H++CO32–
H++CO32–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
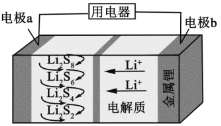
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池充电时间越长,电池中Li2S2的量越多
C.石墨烯的作用主要是提高电极a的导电性
D.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)市场上出售的“热敷袋”是利用原电池原理产生热量,主要成分是铁屑、碳粉和少量的NaCl、水等。“热敷袋”在启用前用塑料袋使之与空气隔绝;启用时打开塑料袋轻轻揉搓,就会放出热量,使用后,会发现袋内有许多铁锈生成。请回答:
①碳粉的作用是___________________,加入NaCl的作用是________________________。
②正极反应的方程式为______________________________________。
③写出使用后生成铁锈所发生的氧化还原反应的化学方程式______________________________________________________________________。
(2)一种既能供电又能固氮的新型氢氮燃料电池的工作原理如图所示:其中电解液为溶有化合物A的稀盐酸。回答下列问题:
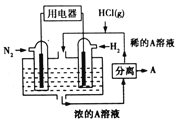
①电子从通入______(填“N2”或“H2”)的电极流出,化合物A为_________(填化学式)
②正极的电极方程式为________________________________。
③电路中通过2.4mol电子时,两极共消耗标准状况下的气体___________L。
④放电过程中电解质溶液的PH会_______(填“增大”或“减小””或“不变”),为维持电解质PH基本不变,可往溶液中通入________气体(填“NH3”或“HCl”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com