
【题目】下列说法正确的是
A.Na+、Fe2+、Cl–、NO3–等离子能在甲基橙试液显红色的溶液中共存
B.K+、Mg2+、Cl–、I–等离子能在[H+] = 10–12 mol·L–1的溶液中共存
C.NaHS水解的离子方程式为:HS–+H2O ![]() S2–+H3O+
S2–+H3O+
D.NaHCO3的电离方程式为:NaHCO3=Na++HCO3–,HCO3– ![]() H++CO32–
H++CO32–
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.0.1 mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=11
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是


A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是( )
)是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是( )
A.与环戊烯互为同分异构体B.所有碳原子不可能处于同一平面
C.二氯代物有3种D.生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:①![]()
②![]()
③![]()
试据此写出一氧化碳燃烧的热化学方程式___________________________。
Ⅱ.甲乙两池电极材料均为铁棒与铂棒,请回答下列问题:

(1)若电池中均为CuSO4溶液,则下列说法正确的是___________
A.一段时间后,甲乙两池中Pt棒上都有红色物质析出
B.甲池中Fe棒上发生氧化反应,乙池中Fe棒上发生还原反应
C.甲池中Cu2+向Fe棒移动,乙池中Cu2+向Pt棒移动
D.一段时间后,甲池中Fe棒质量减少,乙池中Fe棒质量增加
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式_____________________________________,乙池中Pt棒上的电极反应属于_______反应(填“氧化”或是“还原”)
②甲池中Pt棒上的电极反应式是_______________________________________
③室温下,若乙池转移0.02mol电子后停止实验,该池中溶液体积为2000mL,则溶液混合均匀后pH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是
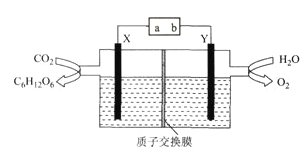
A. 电源a极为正极
B. 该装置中Y电极发生还原反应
C. X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O
D. 理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将下列性质的编号,填入各小题后面对应的横线中:
A.脱水性;B.强酸性;C.氧化性;D.吸水性
①将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。 ______
②在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。 ______
③在冷浓HNO3中放入铝片没明显现象. ______
④用稀硫酸清洗金属表面的氧化物。 ______
(2)矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3-+ 4H2SiO3 + Al2Si2O5(OH)4,这个反应能够发生的原因是 ______ 。
(3)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(每组只能选一次,不能重复选)
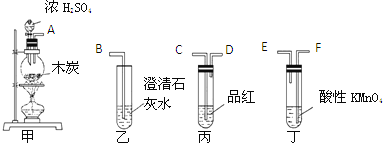
①如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):______ 接 ______ , ______ 接 ______ , ______ 接 ______ ;
②有怎样的实验现象才表明已检验出CO2? ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种抗酸药![]() 仅含五种短周期元素
仅含五种短周期元素![]() 的组成和性质,设计并完成了如下实验:
的组成和性质,设计并完成了如下实验:
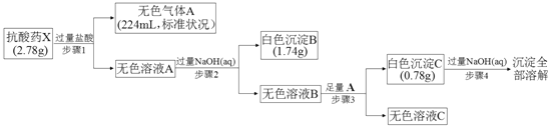
请回答下列问题:
(1)白色沉淀B中金属元素的离子结构示意图为______,A的电子式为______。
(2)步骤3中生成沉淀C的离子方程式为______。
(3)X的化学式为______,该抗酸药不适合胃溃疡重症患者使用,原因是_____________________。
(4)设计实验方案验证溶液C中的含碳离子______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为_________。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g)![]() N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为_____L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是______:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)___V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序___________。
③d、e点对应溶液中,水电离程度大小关系是d______e(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com