
����Ŀ��(1)���������ʵı�ţ������С������Ӧ�ĺ����У�
A.��ˮ�ԣ�B.ǿ���ԣ�C.�����ԣ�D.��ˮ��
������������װ��ŨH2SO4�ĸ������У���һ��ʱ�䵨�����ɫ�� ______
�����ձ��з������ǣ�����ŨH2SO4��ڣ��������������塣 ______
������ŨHNO3�з�����Ƭû��������. ______
����ϡ������ϴ�������������� ______
(2)��Ȫˮһ��������ʯ�绯����ˮ�ܽ����п��ܲ������ɵģ��˴���ָ�ķ绯������ָ������ˮ��CO2ͬʱ���õĹ��̣�����س�ʯ(KAlSi3O8)�绯���ɸ�����[Al2Si2O5(OH)4]���˷�Ӧ�����ӷ���ʽΪ��2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3��+ 4H2SiO3 + Al2Si2O5(OH)4�������Ӧ�ܹ�������ԭ���� ______ ��
(3)Ϊ����֤ľ̿��ŨH2SO4��Ӧ���ɵ�CO2��SO2��ѡ����ͼ��ʾ����(�ں�����)��װ��ʵ��װ�ã�(ÿ��ֻ��ѡһ�Σ������ظ�ѡ)
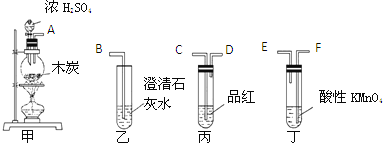
���簴������������������������װ�õ���ȷ˳����(����ӿ���ĸ)��______ �� ______ �� ______ �� ______ �� ______ �� ______ ��
����������ʵ������ű����Ѽ����CO2�� ______ ��
���𰸡�D AC C B ��Ϊ̼�����Աȹ���ǿ A C D F E B ���г��ְ�ɫ��������������KMnO4δ��ȫ��ɫ
��������
�Ţ�����Ũ�������ˮ�ԣ���ȡ���������е�ˮ������Ũ���������ˮ�ԣ�Ũ���Ὣ�����е�H��O��2��1����ʽ��ȥ�����DZ�ڣ�̼��Ũ���ᷴӦ���ɶ�����̼�����������ˮ������Ũ������ʹ��������������һ�����ܵ�����Ĥ�����������Ϊ�����Ķۻ�����ϡ����������������ﷴӦ�����κ�ˮ��
�����Խ�ǿ�����ܹ��Ʊ����Խ������ᣬ��Ϊ̼�����Աȹ���ǿ��
�Ǣٸ���ʵ����ŨH2SO4����ľ̿�ķ�Ӧԭ������������Һ�����·�Ӧ������ѡ����װ�ã�����������Ʒ����Һ��ɫ��������Ʒ����Һ�����������Ĵ��ڣ�������ؿ��������������ø������������Һ��SO2��ͬʱ���ݸ�����ز���ȫ��ɫȷ��SO2�ѳ��ɾ�����֤ľ̿�ɱ�ŨH2SO4������CO2����ͨ��������̼��ʹ�����ʯ��ˮ�����ȷ�ϣ�������Ϊ�����ʯ��ˮ�������ʯ��ˮ�Ͷ�����̼��Ӧ����ǣ������������Ư���ԣ�����������ʹƷ����ɫ����װ���ø������������Һ��SO2����������KMnO4δ��ɫ��˵������������ȫ���ա�
�Ţ�����Ũ�������ˮ�ԣ���ȡ���������е�ˮ���������ɫ���ʴ�Ϊ��D��
����Ũ���������ˮ�ԣ�Ũ������ˮϡ�Ͷ��ų��������ȣ�Ũ���Ὣ�����е�H��O��2��1����ʽ��ȥ�����DZ�ڣ�Ũ�������ǿ�����ԣ�̼��Ũ���ᷴӦ���ɶ�����̼�����������ˮ�������д̼�����ζ�����壬�ʴ�Ϊ��AC��
����Ũ������ʹ��������������һ�����ܵ�����Ĥ�����������Ϊ�����Ķۻ������ֵ�Ũ�����ǿ�����ԣ��ʴ�Ϊ��C��
��ϡ����������������ﷴӦ�����κ�ˮ����ϡ������ϴ��������������������ϡ��������ԣ��ʴ�Ϊ��B��
�����Խ�ǿ�����ܹ��Ʊ����Խ������ᣬ��Ϊ̼�����Աȹ���ǿ������2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3��+ 4H2SiO3 + Al2Si2O5(OH)4���ܹ��������ʴ�Ϊ����Ϊ̼�����Աȹ���ǿ��
�Ǣٸ���ʵ����ŨH2SO4����ľ̿�ķ�Ӧԭ������������Һ�����·�Ӧ������ѡ����װ�ã�����������Ʒ����Һ��ɫ��������Ʒ����Һ�����������Ĵ��ڣ�������ؿ��������������ø������������Һ��SO2��ͬʱ���ݸ�����ز���ȫ��ɫȷ��SO2�ѳ��ɾ�����֤ľ̿�ɱ�ŨH2SO4������CO2����ͨ��������̼��ʹ�����ʯ��ˮ�����ȷ�ϣ��ʴ�Ϊ��A��C��D��F��E��B��
������Ϊ�����ʯ��ˮ�������ʯ��ˮ�Ͷ�����̼��Ӧ����ǣ������������Ư���ԣ�����������ʹƷ����ɫ����װ���ø������������Һ��SO2����������KMnO4δ��ɫ��˵������������ȫ���գ��ʴ�Ϊ�����г��ְ�ɫ��������������KMnO4δ��ȫ��ɫ��


 �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����![]()
A.![]() ʱ����
ʱ����![]() ��̼������Һ��ˮϡ��100����������Һ��
��̼������Һ��ˮϡ��100����������Һ��![]()
B.pH��ͬ������ʹ�����Һ�ֱ�������þ�۷�Ӧ���������![]() �������
�������
C.![]() ʱ��
ʱ��![]() ��HA������Һ��
��HA������Һ��![]() ��NaOH��Һ�������ϣ�������ҺpHһ��С��7
��NaOH��Һ�������ϣ�������ҺpHһ��С��7
D.![]() ��Һ�м���һ����
��Һ�м���һ����![]() ���壬��Һ��
���壬��Һ��![]() ������֤��
������֤��![]() Ϊ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�л�ѧ�����ѵĹ���һ��������ѧ�仯
B.�Ȼ�����һ�ֵ���ʣ���ⱥ��ʳ��ˮ���Ƶý�����
C.��pH��a�Ĵ���ϡ��ΪpH��a + 1�Ĺ����У�c(CH3COOH)/c(H��)��С
D.SiO2���������������ǿ����Һ��Ӧ���������κ��ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��Na+��Fe2+��Cl�C��NO3�C���������ڼ�����Һ�Ժ�ɫ����Һ�й���
B��K+��Mg2+��Cl�C��I�C����������[H+] = 10�C12 mol��L�C1����Һ�й���
C��NaHSˮ������ӷ���ʽΪ��HS�C��H2O ![]() S2�C��H3O+
S2�C��H3O+
D��NaHCO3�ĵ��뷽��ʽΪ��NaHCO3��Na+��HCO3�C��HCO3�C ![]() H+��CO32�C
H+��CO32�C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�������һ��2L���ܱ�������������4 molA��2molB�������·�Ӧ��
3A(g)+2B(g)![]() 4C(s)+D(g)����Ӧ2 min��ﵽƽ�����������1.6 mol C������˵����ȷ����( )
4C(s)+D(g)����Ӧ2 min��ﵽƽ�����������1.6 mol C������˵����ȷ����( )
A. ǰ2min��D��ƽ����Ӧ����Ϊ0.2mol/(L��min)
B. ��ʱ��B��ƽ��ת������40��
C. ����B��ƽ�������ƶ���B��ƽ��ת��������
D. �������ϵ��ѹǿ��ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤��ԭ����ͼ��ʾ�����е缫a���ò���ʯīϩ��S8���ϣ���ط�ӦΪ��16Li+xS8=8Li2Sx��2��x��8��������˵���������
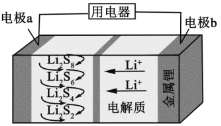
A.��ع���ʱ�������ɷ�����Ӧ��2Li2S6+2Li++2e-=3Li2S4
B.��س��ʱ��Խ���������Li2S2����Խ��
C.ʯīϩ��������Ҫ����ߵ缫a�ĵ�����
D.��ع���ʱ�����·������0.02 mol���ӣ��������ϼ���0.14 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����P�Ľṹ��ͼ��ʾ������RΪ�����������й���ά����P��������ȷ����
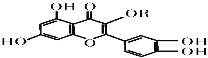
A.�����еĹ��������ǻ���̼̼˫�����Ѽ�������
B.��RΪ����������ʵķ���ʽ���Ա�ʾΪC16H12O7
C.1 mol�û�������������NaOH Ϊ5mol
D.1 mol�û��������������ˮ�е���5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10L�����ܱ������з�����Ӧ��X��g��+Y��g��2Z��g����H��0��T��ʱ�������ʵ����ʵ�����ʱ���ϵ���±�������˵����ȷ����
ʱ��/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
0 | 0.20 | 0.60 | 0 |
10 | a1 | a2 | 0.25 |
13 | b1 | 0.45 | b2 |
15 | d1 | d2 | 0.30 |
A.ǰ10 min�ڵ�ƽ����Ӧ����v��Y��=2.5��10��3mol/��Lmin��
B.���������������䣬�����¶ȣ���Ӧ��ƽ��ʱc��X����5.0��10��3mol/L
C.����ʼʱֻ����0.60molZ��g������Ӧ��ƽ��ʱZ��g����ת����Ϊ50%
D.����ʼʱ����0.60molX��g����0.10molY��g����0.50molZ��g�����ﵽƽ��ǰv��������v���棩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ͼװ��̽��SO2�����ʡ�

�����йط�Ӧ�ķ���ʽ������ȷ���ǣ� ��
A. ������Һ�Ժ�ɫ��ԭ�� CO32��+ H2O![]() HCO3��+ OH��
HCO3��+ OH��
B. ������Һ��ɫ��ȥ��ԭ��2SO2 + CO32��+ H2O == CO2+ 2HSO3��
C. ������Һ�Ի���ɫ��ԭ��Cl2+ H2O == HCl + HClO
D. ������Һ����ɫ��ȥ��ԭ��SO2+ Cl2 + 2H2O == H2SO4 + 2HCl
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com