
【题目】氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为_________。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g)![]() N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为_____L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是______:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)___V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序___________。
③d、e点对应溶液中,水电离程度大小关系是d______e(填“>”、“<”或“=”)。
【答案】C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol 6.67 A < NH4+ c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) >
【解析】
(1)先求出偏二甲肼的物质的量,再根据物质的量之比等于热量比求出反应热,然后写出热化学方程式;
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,带入平衡常数表达式计算;
②A.气体的质量不变,容积恒定,因此气体的密度为一定值;
B.混合气体的颜色不变,说明NO2的浓度保持恒定;
C.反应2NO2(g)N2O4(g)气压恒定时,正、逆反应速率相等;
③反应为放热反应,升高温度,K值减小,计算可知此时的浓度商Q=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
(3)①a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;
②c点溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分;
③根据碱性溶液中,氢氧根离子浓度越大,水的电离程度越小进行分析。
(1)偏二甲肼(C2H8N2)和液态N2O4反应,生成无毒、无污染的气体氮气和水,已知1 g燃料完全燃烧释放出的能量为42.5 kJ,则1 mol燃料完全燃烧释放出的能量为2550 kJ,所以该反应的热化学方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol;
(2)①由图像可知看出c(N2O4)=0.6mol/L,N2O4的浓度为NO2的2倍,则c(NO2)=0.3,298k时,该反应的平衡常数为![]() = 6.67;
= 6.67;
②A.在恒容密闭容器中,混合气体的密度始终保持不变,不能说明反应处于平衡状态;
B.NO2是红棕色气体,当反应向右进行时,混合气体的颜色变浅,当混合气体的颜色不再变化时,反应处于平衡状态;
C.该反应是气体体积减小的可逆反应,压强随着反应的进行而减小,当气压恒定时,反应处于平衡状态;
故选A。
③在398K,某时刻测得n(NO2)="0.6" mol,n(N2O4)=1.2mol,该容器的体积为2 L,Q=![]() =6.67,等于298K时的平衡常数,而该反应是放热反应,升高温度,K值减小,所以Q>K (398K),平衡逆向移动,则此时V(正)<V(逆);
=6.67,等于298K时的平衡常数,而该反应是放热反应,升高温度,K值减小,所以Q>K (398K),平衡逆向移动,则此时V(正)<V(逆);
(3)①在b点,等浓度、等体积的NH4HSO4与NaOH溶液1:1恰好反应生成硫酸铵,溶液中发生水解反应的离子是NH4+ ;
②在c点,溶液呈中性,c(OH-)=c(H+)但最小,在b点溶液中含有等物质的量的Na+、NH4+ 、SO42-,该溶液因NH4+ 的水解而显酸性,要想使溶液呈中性,需再加NaOH到c点,所以溶液中各离子浓度由大到小的排列顺序为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
③d点是硫酸铵和氨水的混合溶液,氨水的浓度较大,对水的电离抑制程度较弱,e点是硫酸钠与氨水的混合溶液,氨水的浓度较大,对水的电离抑制程度较大,所以d、e点对应溶液中,水电离程度大小关系是d>e。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.Na+、Fe2+、Cl–、NO3–等离子能在甲基橙试液显红色的溶液中共存
B.K+、Mg2+、Cl–、I–等离子能在[H+] = 10–12 mol·L–1的溶液中共存
C.NaHS水解的离子方程式为:HS–+H2O ![]() S2–+H3O+
S2–+H3O+
D.NaHCO3的电离方程式为:NaHCO3=Na++HCO3–,HCO3– ![]() H++CO32–
H++CO32–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L恒容密闭容器中发生反应:X(g)+Y(g)2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是
时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.20 | 0.60 | 0 |
10 | a1 | a2 | 0.25 |
13 | b1 | 0.45 | b2 |
15 | d1 | d2 | 0.30 |
A.前10 min内的平均反应速率v(Y)=2.5×10﹣3mol/(Lmin)
B.保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10﹣3mol/L
C.若起始时只充入0.60molZ(g),反应达平衡时Z(g)的转化率为50%
D.若起始时充入0.60molX(g)、0.10molY(g)和0.50molZ(g),达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)市场上出售的“热敷袋”是利用原电池原理产生热量,主要成分是铁屑、碳粉和少量的NaCl、水等。“热敷袋”在启用前用塑料袋使之与空气隔绝;启用时打开塑料袋轻轻揉搓,就会放出热量,使用后,会发现袋内有许多铁锈生成。请回答:
①碳粉的作用是___________________,加入NaCl的作用是________________________。
②正极反应的方程式为______________________________________。
③写出使用后生成铁锈所发生的氧化还原反应的化学方程式______________________________________________________________________。
(2)一种既能供电又能固氮的新型氢氮燃料电池的工作原理如图所示:其中电解液为溶有化合物A的稀盐酸。回答下列问题:
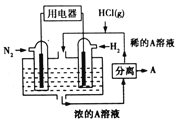
①电子从通入______(填“N2”或“H2”)的电极流出,化合物A为_________(填化学式)
②正极的电极方程式为________________________________。
③电路中通过2.4mol电子时,两极共消耗标准状况下的气体___________L。
④放电过程中电解质溶液的PH会_______(填“增大”或“减小””或“不变”),为维持电解质PH基本不变,可往溶液中通入________气体(填“NH3”或“HCl”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
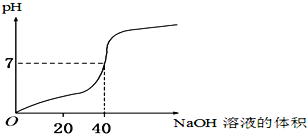
A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000 mol/L NaOH溶液滴定未知浓度的盐酸溶液,操作可分解为如下几步:
A.用蒸馏水洗干净滴定管;B. 用待测定的溶液润洗酸式滴定管;C.用酸式滴定管取稀盐酸20.00 mL,注入锥形瓶中,加入酚酞;D.另取锥形瓶,再重复操作一次;E.检查滴定管是否漏水;F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)_____________。
(2)操作F中应该选择图中________滴定管(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应观察________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是____________________________。
(4)滴定结果如表所示:
滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20 | 1.02 | 21.03 |
2 | 20 | 2.00 | 25.00 |
3 | 20 | 0.60 | 20.60 |
滴定中误差较大的是第________次实验,造成这种误差的可能原因是________。
A. 碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B. 滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C. 滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D. 达到滴定终点时,仰视溶液凹液面最低点读数
E. 滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为________mol/L。
(6)如果准确移取20.00 mL 0.1000 mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图装置探究SO2的性质。

下列有关反应的方程式,不正确的是( )
A. ①中溶液显红色的原因: CO32-+ H2O![]() HCO3-+ OH-
HCO3-+ OH-
B. ①中溶液红色褪去的原因:2SO2 + CO32-+ H2O == CO2+ 2HSO3-
C. ②中溶液显黄绿色的原因:Cl2+ H2O == HCl + HClO
D. ②中溶液黄绿色褪去的原因:SO2+ Cl2 + 2H2O == H2SO4 + 2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,常温时将一滴管液体Y一次性全部挤到充满O2的锥形瓶内(装置气密性良好),若锥形瓶内气体的最大物质的量是a mol,久置后其气体的物质的量是b mol,不存在a>b关系的是( )
X | Y |
| |
A | 过量C、Fe碎屑 | 稀HCl | |
B | 过量Na2CO3粉末 | 稀H2SO4 | |
C | 过量Fe、Al碎屑 | 浓H2SO4 | |
D | 过量Cu、CuO粉末 | 浓HNO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com