
【题目】根据下列流程图,回答有关问题:

(1)写出化合物的结构简式:H____________
(2)下列说法正确的是:__________
A.反应①的试剂与条件为氯气、光照
B.化合物E是乙醛的同分异构体,能发生银镜反应
C.从乙烯到化合物F的转化过程中,涉及的反应类型有氧化反应、加成反应
D.X的分子式为C11H13NCl2
(3)反应④的方程式:__________________________________________________
(4)写出同时符合下列条件的C的所有同分异构体的结构简式:
____________________________________________________________________
①氢谱显示分子中有四种不同化学环境的氢,且苯环上的一溴代物只有两种
②可以发生银镜反应,能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应
(5)设计以甲苯为原料生产水杨酸的合成路线。___________
【答案】  AC
AC ![]() +
+ →
→ +HCl
+HCl ![]() 、
、![]() 、
、![]()

【解析】试题分析:由流程可知,反应①甲苯发生侧链上的取代生成A,A为氯化苄(一氯甲苯),然后氯化苄与氰化钠发生取代反应、水解、酸化后生成B,B为苯乙酸;反应②苯乙酸发生苯环上的取代生成C,C为邻氯苯乙酸;反应③邻氯苯乙酸发生取代反应生成 ;乙烯氧化为E,E为环氧乙烷,然后环氧乙烷与甲胺发生(开环)加成反应生成F,F为
;乙烯氧化为E,E为环氧乙烷,然后环氧乙烷与甲胺发生(开环)加成反应生成F,F为![]() ,
,![]() 与
与 发生取代反应生成G,G为
发生取代反应生成G,G为 ,G与乙硼烷反应生成H,H与五氯化磷反应生成X(
,G与乙硼烷反应生成H,H与五氯化磷反应生成X( ),对比G与X的结构并结合两步反应的条件,可以推断,H为
),对比G与X的结构并结合两步反应的条件,可以推断,H为 。
。
(1)H的结构简式为 。
。
(2)A.反应①的试剂与条件为氯气、光照,A正确;B.化合物E是乙醛的同分异构体,但是因其没有醛基,故其不能发生银镜反应,B不正确;C.从乙烯到化合物F的转化过程中,涉及的反应类型有氧化反应(乙烯到环氧乙烷)、加成反应(E到F),C正确;D.X( )的分子式为C11H15NCl2,D不正确。综上所述,说法正确的是AC 。
)的分子式为C11H15NCl2,D不正确。综上所述,说法正确的是AC 。
(3)反应④的方程式为![]() +
+ →
→ +HCl。
+HCl。
(4)①氢谱显示分子中有四种不同化学环境的氢,且苯环上的一溴代物只有两种,则苯环上可能有两个互为对位的取代基(或苯环上只有种个可以被取代的H);②可以发生银镜反应,则其分子中有醛基;有氯原子,能发生水解反应,,水解产物之一能与FeCl3溶液发生显色反应,则其水解产物有酚羟基,氯原子有可能直接连在苯环上、水解后得到酚羟基(题中有信息),或者酯基水解后生成酚羟基,。同时符合上述条件的C( )的同分异构体有
)的同分异构体有![]() 、
、![]() 、
、![]() 等,共3种。
等,共3种。
(5)以甲苯为原料生产水杨酸(邻羟基苯甲酸),可以先由甲苯与氯气发生苯环上的取代制取邻氯甲苯,然后再用邻氯甲苯与酸性高锰酸钾溶液反应制备邻氯苯甲酸,最后经水解、酸化得到水杨酸。具体合成路线如下:


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
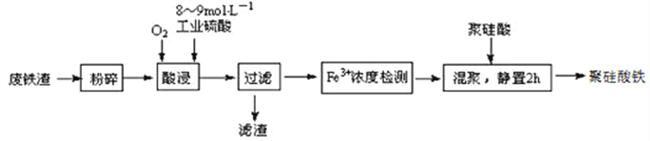
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为_________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O)2] 3+的几何异构体种数有(不考虑光学异构)___________种。
(3)金属钴是由______键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,Co2+和Fe2+的离子半径分别为74.5pm和78pm,则熔点CoO______FeO。
(4)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿佛加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、Pt﹣Fe合金网为电极材料的海水电池.在这种电池中①铝合金是阳极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应( )
A.②③
B.②④
C.①②
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制城法”生产纯碱和化肥NH4Cl.工艺流程如图所示。下列有关说法不正确的是

A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 粗盐可采用除杂和重结晶等过程提纯
C. 流程图中的系列操作中用到的玻璃仪器可能有玻璃棒、烧杯、漏斗、坩埚等
D. 该流程中得到的晶体用到了溶解度的差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用浓H2SO4配制480mL 0.2mol·L-1的稀H2SO4。
(1)需要量取98%密度为1.84g·cm-3的浓硫酸________mL。
(2)配制时,必须使用的仪器有______(填代号),还缺少的仪器是_________、_________。
①烧杯;②10mL量筒;③20mL量筒;④托盘天平(带砝码);⑤玻璃棒
(3)配制时,该实验两次用到玻璃棒,其作用分别是________________、_______________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”、“无影响”)。
①容量瓶没有干燥________,
②用量筒量取98%的硫酸溶液时俯视________,
③溶液转移到容量瓶后,未进行洗涤操作_________ ,
④定容时俯视容量瓶__________,
⑤如果加水超过了刻度线,取出水使液面恰好到刻度线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
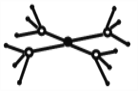
【题目】周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子。回答下列问题:
(1)Y、Z、T中单质熔点最高是______(填元素符号)
(2)比W原子序数少5的基态原子中单电子数为_________________。
(3)T与Z形成的化合物中,中心原子杂化类型是_______
(4)X和上述其他元素中的一种形成的化合物中:分子呈三角锥形的是________(填化学式);分子中既含有极性共价键,又含有非极性共价键的化合物是_______(填化学式,写一种)。
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,阳离子的结构如图所示。该配合物的化学式为__________,阳离子中存在的化学键类型有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2(g)+O2(g) 2SO3(g),达到平衡时: n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )
A. 1.2 mol B. 0.4 mol C. 0.8 mol D. 0.6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com