
【题目】已知: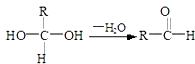
请根据下图回答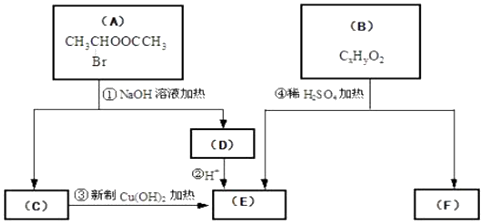
(1)E中含有的官能团的名称是;③的反应类型是 , C跟新制的氢氧化铜反应的化学方程式为: .
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2):n(H2O)=2:1.则B的分子式为 , F的分子式为 .
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11μm线宽芯片的关键技术.F是这种高分子光阻剂生产中的主要原料.F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种.F在一定条件下发生加聚反应的化学方程式为: .
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应.G可能有种结构,写出其中任意一种同分异构体的结构简式 .
【答案】
(1)羧基,氧化反应,CH3CHO+2Cu(OH)2 ![]() CH3COOH+Cu2O↓+2H2O
CH3COOH+Cu2O↓+2H2O
(2)C10H10O2,C8H8O
(3)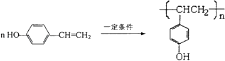
(4)4,![]() 或
或 ![]() (或间位、邻位任一种)
(或间位、邻位任一种)
【解析】解:(1)A在氢氧化钠水溶液、加热条件下发生水解反应C,根据A的结构中含有酯基、﹣Br,结合反应信息一个碳原子上连有两个羟基不稳定,转化为C=O,结合转化关系可推知C为CH3CHO,C与新制氢氧化铜反应生成E,故E为CH3COOH,含有的官能团名称是:羧基,反应③是乙醛发生氧化氧化反应生成乙酸,反应方程式为:CH3CHO+2Cu(OH)2 ![]() CH3COOH+Cu2O↓+2H2O,
CH3COOH+Cu2O↓+2H2O,
所以答案是:羧基,氧化反应,CH3CHO+2Cu(OH)2 ![]() CH3COOH+Cu2O↓+2H2O;
CH3COOH+Cu2O↓+2H2O;
(2)B在浓硫酸作用下生成乙酸与F,B应是酯,B的分子式为CxHyO2,相对分子质量为162,B分子中基团﹣CxHy的式量为162﹣32=130,故12x+y=13,所以 ![]() =10…10,故x的最大值为10,H原子数目为10,根据C原子与H原子的关系,x的值只能为10,故B的分子式为:C10H10O2,可推知F的分子式=C10H10O2+H2O﹣C2H4O2=C8H8O,
=10…10,故x的最大值为10,H原子数目为10,根据C原子与H原子的关系,x的值只能为10,故B的分子式为:C10H10O2,可推知F的分子式=C10H10O2+H2O﹣C2H4O2=C8H8O,
所以答案是:C10H10O2;C8H8O;
(3)F的相对分子质量为:162+18﹣60=120,F的结构中含有1个﹣OH,F能跟FeCl3溶液发生显色反应,说明含有苯环、酚羟基,决定为苯的二元取代,故剩余基团的相对分子质量为120﹣76﹣17=27,F能发生加聚反应,故还含有C=C,苯环上的一氯代物只有两种,说明为苯环二元对称取代,故F为 ![]() ,在一定条件下发生加聚反应生成高聚物,反应方程式为:
,在一定条件下发生加聚反应生成高聚物,反应方程式为:  ,
,
所以答案是: 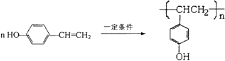 ;
;
(4)化合物G是 ![]() 的同分异构体,它属于芳香族化合物,能发生银镜反应,说明含有苯环与醛基﹣CHO,若含有一个支链为﹣CH2CHO,只有1种结构,若有2个支链,则分别为﹣CH3、﹣CHO,2个支链有邻、间、对三种位置关系,有3种结构,故符合条件的化合物G的结构有1+3=4种,符合条件的同分异构体为:
的同分异构体,它属于芳香族化合物,能发生银镜反应,说明含有苯环与醛基﹣CHO,若含有一个支链为﹣CH2CHO,只有1种结构,若有2个支链,则分别为﹣CH3、﹣CHO,2个支链有邻、间、对三种位置关系,有3种结构,故符合条件的化合物G的结构有1+3=4种,符合条件的同分异构体为: ![]() 或
或 ![]() (或间位、邻位任一种),
(或间位、邻位任一种),
所以答案是:4; ![]() 或
或 ![]() (或间位、邻位任一种).
(或间位、邻位任一种).


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】水中的溶解氧是水生生物生存不可缺少的条件.某课外小组采用碘量法测定学校周边河水中的溶解氧.实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化、滴定
在碘量瓶中将因氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+(该反应放热),在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O ![]() +I2═2I﹣+S4O
+I2═2I﹣+S4O ![]() )
)
回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为 .
(2)水样酸化后发生反应的离子方程式 .
(3)在碘量瓶(如图)中进行反应,要盖上塞子且在塞子上倒少量水,这样做的目的是 . 
(4)Na2S2O3溶液不稳定,易被氧化,且易受到水中CO2以及微生物的影响而分解,配制该溶液时需要的蒸馏水必须经过煮沸、冷却后才能使用,其目的是 .
(5)Na2S2O3溶液不稳定,使用前需标定,KIO3做其准物标定Na2S2O3溶液的浓度,称取0.214g KIO3与过量的KI作用,析出的碘用Na2S2O3溶液滴定,用去24.00mL,此Na2S2O3溶液的浓度为(已知M(KIO3)=214.0gmol﹣1)
(6)取100.00mL 水样经固氧、酸化后,用该 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为;若消耗Na2S2O3溶液的体积为10mL,则水样中溶解氧的含量为mgL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验基本操作的叙述不正确的是( )
A. 使用分液漏斗和容量瓶时,首先要查仪器是否漏液
B. 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生暴沸
C. 用蒸发皿进行加热蒸发时,不需垫石棉网可直接进行
D. 将浓硫酸倒入盛水的量筒中稀释成稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜(Cu-Zn)是我国最早大量使用的合金,其中锌是现代工业上常用金属。
I. 某废催化剂含58.2%的SiO2(不溶于水和稀酸)、21.0%的ZnO、4.5%的ZnS(不溶于水但溶于稀酸)和12.8%的CuS(不溶于水也不溶于稀酸)。某同学用15.0 g该废催化剂为原料,以稀硫酸和H2O2为试剂,回收其中的锌和铜。
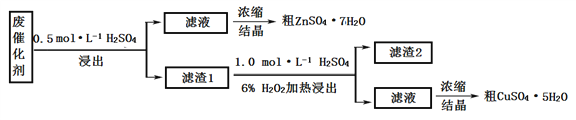
(1)浸出后的操作中,使用到的玻璃仪器有:烧杯、玻璃棒、__________________。
(2)滤渣2是______,第二次浸出发生的反应化学方程式是_________________________。
(3)两次结晶的操作是_________________________________________________________。
(4)某同学在实验完成之后,得到1.5gCuSO4·5H2O(M=250 g·mol–1),则铜的回收率为_______。
II.锌的化学性质与铝相似,锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(5)Al溶于NaOH溶液,反应的离子方程式为:_______________________________。
(6)Zn溶于NaOH溶液,反应的化学方程式为:_______________________________。
(7)下列各组中的两种溶液,用相互滴加的实验方法不可鉴别的是____________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面三个图是某研究小组利用过氧化氢酶探究H2O2分解条件而获得的实验结果.请回答下列有关问题:

(1)图1、2、3所代表的实验中,实验自变量依次为 , , .
(2)根据图1可以得出的实验结论是 _.
(3)图2曲线bc段产生的最可能原因是 .
(4)若进行图2所代表的实验时增加过氧化氢酶的含量,请在图2中,利用虚线绘出曲线的变化
(5)能否以H2O2为材料来探究温度对H2O2酶活性的影响? 为什么 .
(6)酶的作用原理 ,酶的本质 . .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得。( )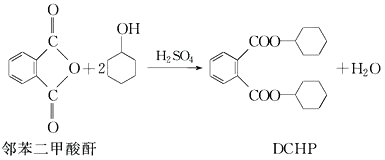
下列说法正确的是
A.邻苯二甲酸酐的二氯代物有2种
B.环己醇分子中所有的原子可能共平面
C.DCHP能发生加成、取代、消去反应
D.1 mol DCHP与氢氧化钠溶液反应,最多可消耗2 molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的分类方法,HNO3应属于
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥一元酸 ⑦化合物
A.①②③④⑤⑥⑦B.①④⑥⑦
C.①④⑤⑦D.①④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com