
【题目】青铜(Cu-Zn)是我国最早大量使用的合金,其中锌是现代工业上常用金属。
I. 某废催化剂含58.2%的SiO2(不溶于水和稀酸)、21.0%的ZnO、4.5%的ZnS(不溶于水但溶于稀酸)和12.8%的CuS(不溶于水也不溶于稀酸)。某同学用15.0 g该废催化剂为原料,以稀硫酸和H2O2为试剂,回收其中的锌和铜。
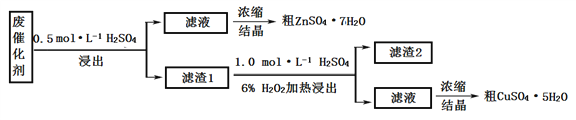
(1)浸出后的操作中,使用到的玻璃仪器有:烧杯、玻璃棒、__________________。
(2)滤渣2是______,第二次浸出发生的反应化学方程式是_________________________。
(3)两次结晶的操作是_________________________________________________________。
(4)某同学在实验完成之后,得到1.5gCuSO4·5H2O(M=250 g·mol–1),则铜的回收率为_______。
II.锌的化学性质与铝相似,锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(5)Al溶于NaOH溶液,反应的离子方程式为:_______________________________。
(6)Zn溶于NaOH溶液,反应的化学方程式为:_______________________________。
(7)下列各组中的两种溶液,用相互滴加的实验方法不可鉴别的是____________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
【答案】 漏斗 SiO2 CuS+4H2O2 =CuSO4+4H2O 加热浓缩冷却结晶过滤 30% 2Al+ 2OH﹣+2H2O= 2AlO2-+ 3H2↑或2Al+2NaOH+6H2O= 2Na[Al(OH)4]+ 3H2↑ Zn+2NaOH= Na2ZnO2+ H2↑或Zn+2NaOH+2H2O= Na2[Zn(OH)4]+ H2↑ ②
【解析】(1)浸出后的操作是过滤,使用到的玻璃仪器有:烧杯、玻璃棒、漏斗。(2)二氧化硅、CuS不溶于稀硫酸,则滤渣1是SiO2、CuS。加入硫酸酸化的双氧水氧化CuS生成硫酸铜,所以滤渣2是SiO2;第二次浸出发生的反应化学方程式是CuS+4H2O2=CuSO4+4H2O。(3)两次结晶的操作是加热浓缩冷却结晶过滤。(4)1.5gCuSO4·5H2O中铜的质量是![]() ,则铜的回收率为
,则铜的回收率为 。(5)Al溶于NaOH溶液生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2-+3H2↑。(6)根据铝与氢氧化钠溶液反应的方程式可知Zn与NaOH溶液反应的化学方程式为Zn+2NaOH=Na2ZnO2+H2↑。(7)①硫酸铝滴入氢氧化钠溶液中开始生成偏铝酸钠,氢氧化钠滴入硫酸铝溶液中立即产生白色沉淀,可以鉴别;②硫酸铝和氨水无论怎么滴加均产生白色沉淀,不能鉴别;③类似于硫酸铝与氢氧化钠,硫酸锌和氢氧化钠滴加顺序不同时实验现象不同,可以鉴别;④由于氢氧化锌能溶于氨水,生成Zn(NH3)42+,所以硫酸锌和氨水可以利用滴加顺序的不同进行鉴别,即硫酸锌滴入氨水中开始没有沉淀,而氨水滴入硫酸锌中立即产生沉淀,答案选②。
。(5)Al溶于NaOH溶液生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2-+3H2↑。(6)根据铝与氢氧化钠溶液反应的方程式可知Zn与NaOH溶液反应的化学方程式为Zn+2NaOH=Na2ZnO2+H2↑。(7)①硫酸铝滴入氢氧化钠溶液中开始生成偏铝酸钠,氢氧化钠滴入硫酸铝溶液中立即产生白色沉淀,可以鉴别;②硫酸铝和氨水无论怎么滴加均产生白色沉淀,不能鉴别;③类似于硫酸铝与氢氧化钠,硫酸锌和氢氧化钠滴加顺序不同时实验现象不同,可以鉴别;④由于氢氧化锌能溶于氨水,生成Zn(NH3)42+,所以硫酸锌和氨水可以利用滴加顺序的不同进行鉴别,即硫酸锌滴入氨水中开始没有沉淀,而氨水滴入硫酸锌中立即产生沉淀,答案选②。


科目:高中化学 来源: 题型:
【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组只领取了以下实验用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只使用上述仪器,不能进行的实验操作是( )
A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,CH3COOH和NH3H2O的电离常数相等.
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3. ①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为 , 溶液中 ![]() (填“增大”“减小”“不变”或“不能确定”).
(填“增大”“减小”“不变”或“不能确定”).
②25℃时,0.1mol/L氨水(NH3H2O溶液)的pH= . 用pH试纸测定该氨水pH的操作方法为 .
③氨水(NH3H2O溶液)电离平衡常数表达式Kb= , 25℃时,氨水电离平衡常数约为 .
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中 ![]() (填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
当加入CH3COOH溶液体积为10mL时,混合溶液的pH7(填“>”“=”“<”).
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图.已知:pOH=﹣lgc(OH﹣). 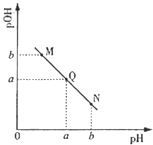
①图中M,Q,N三点所示溶液中水的电离程度最大的是(填字母).
②若Q点时滴加醋酸溶液体积为V2 mL,则V1V2(填“>”“=”“<”).
③若在曲线上某一点W时加入醋酸的体积为V1 mL,则W点应位于图中曲线上Q点的(填“上方”“下方”),此时溶液中离子浓度由大到小的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A. SO2、SiO2、CO、CO2均为酸性氧化物,也为非金属氧化物
B. 干冰、氨气、冰水混合物均为纯净物,也为化合物
C. 稀豆浆、雾、淀粉溶液、氯化铁溶液均为胶体,也为混合物
D. 粗盐、酸雨、盐酸、胆矾(CuSO4·5H2O)均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: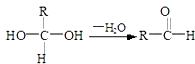
请根据下图回答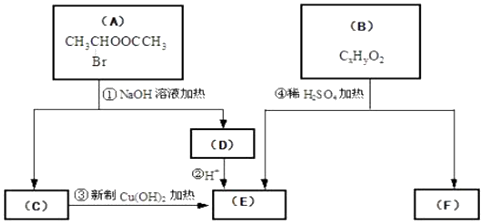
(1)E中含有的官能团的名称是;③的反应类型是 , C跟新制的氢氧化铜反应的化学方程式为: .
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2):n(H2O)=2:1.则B的分子式为 , F的分子式为 .
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11μm线宽芯片的关键技术.F是这种高分子光阻剂生产中的主要原料.F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种.F在一定条件下发生加聚反应的化学方程式为: .
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应.G可能有种结构,写出其中任意一种同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。某学生用如图所示实验装置,完成还原铁粉与水蒸气反应的实验。
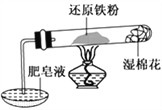
(1)实验中使用肥皂液的作用是___________________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质有:______________________________;不能确定是否存在Fe3O4的原因是:___________________________________________。
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。

①溶液X中发生氧化还原反应的离子方程式为___________;
②操作a为_______,检验沉淀是否已经洗涤干净的操作是___________________。
③如果取固体样品m1克,反应后得到红棕色固体m2克,则m1与m2之比最少应大于______时,才能确定固体样品中一定存在Fe3O4。
(4)丙同学将试管内固体看做铁的氧化物(FexO),取出6.08g溶于足量盐酸中,向所得溶液中通入448mLCl2(标准状况),恰好将Fe2+完全氧化。则X=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中氧化剂是 .
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,你认为必须选用的物质有 (填序号).
(3)某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式
Al+ NaNO3+ NaOH═ NaAlO2+ N2↑+ H2O
若反应过程中转移5mol 电子,则生成标准状况下N2的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中每方框表示有关的一种反应物或生成物,方框中的字母是有关主要反应物或生成物的代码,其中C、E、G、I、X常温常压下是气体。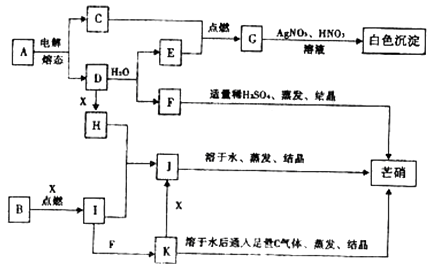
(1)B的化学式为;H的电子式为。
(2)写出A的电解方程式。
(3)写出固体H和气体I反应生成J的化学方程式,并注明电子转移的方向和数目。
(4)将C气体通入K溶液后,溶液的pH将会(填升高、降低、或不变),写出该反应的离子方程式。
(5)写出D和水反应的离子方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com