
����Ŀ����ͼ��ÿ�����ʾ�йص�һ�ַ�Ӧ�������������е���ĸ���й���Ҫ��Ӧ���������Ĵ��룬����C��E��G��I��X���³�ѹ�������塣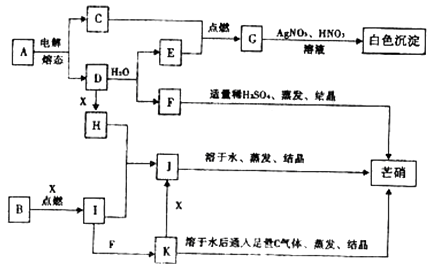
��1��B�Ļ�ѧʽΪ��H�ĵ���ʽΪ��
��2��д��A�ĵ�ⷽ��ʽ��
��3��д������H������I��Ӧ����J�Ļ�ѧ����ʽ����ע������ת�Ƶķ������Ŀ��
��4����C����ͨ��K��Һ����Һ��pH����(�����ߡ����͡���)��д���÷�Ӧ�����ӷ���ʽ��
��5��д��D��ˮ��Ӧ�����ӷ���ʽ��
���𰸡�
��1��S��![]()
��2��2NaCl(����) ![]() 2Na��Cl2��
2Na��Cl2��
��3��
��4�����ͣ�SO32��+Cl2+2H2O=SO42��+2Cl��+4H+
��5��2Na+2H2O=2Na++H2��+2OH-��2�֣�
��������C��E��G��I���³�ѹ�������壬�������и�����ת����ϵ��C��E��ȼ����G��G�������ữ����������Ӧ���ɰ�ɫ�����������֪GΪHCl��C��EΪH2��Cl2 �� E��D��ˮ��Ӧ�õ�������EΪH2 �� ��CΪCl2 �� â������Ҫ�ɷ�Ϊ�����ƣ����Կ���֪DΪNa��FΪNaOH����AΪNaCl��J����ˮ�����ᾧ��â��������JΪNa2SO4 �� K��ͨ�������������ᾧҲ�ܵõ������ƣ�������������ǿ�������ԣ���KΪ���л�ԭ�Ե�Na2SO3 �� K��������Ӧ����J������XΪO2 �� ����B��X��ȼ������I��I��H����J����I��������K����֪��BΪS��IΪSO2 �� HΪNa2O2��
(1)�����Ϸ�����֪BΪS��HΪNa2O2 �� �����ʽΪ ![]() ��
��
(2)AΪNaCl��������ڵ�NaCl�����ƺ�����������ʽΪ2NaCl(����) ![]() 2Na��Cl2����
2Na��Cl2����
(3)Na2O2������SO2��Ӧ����Na2SO4 �� ��Ӧ����ʽ�ǣ�Na2O2+SO2=Na2SO4 �� �ڸ÷�Ӧ��Na2O2�������������е�-1�۵�O��õ��ӡ���ΪNa2SO4��-2�۵�O����SO2�е�+4�۵�S��������Ϊ�������е�+6�۵�S����˫���ŷ���ʾ����ת��Ϊ��  ��
��
��4����Cl2ͨ��Na2SO3��Һ����������ԭ��Ӧ���������ƺ����ᣬ���ݵ����غ㡢����غ㼰ԭ���غ�ɵ÷�Ӧ�����ӷ���ʽΪSO32��+Cl2+2H2O=SO42��+2Cl��+4H+��(5)D��Na���ƺ�ˮ��Ӧ�����������ƺ���������Ӧ�����ӷ���ʽΪ2Na+2H2O=2Na++H2��+2OH-��
���ݳ��³�ѹ��������ļ������ʵ�ת����ϵ��Ϊͻ�ƿڽ����ƶϸ������ʣ�Ȼ���ϵ���ʽ����д���Ȼ��Ƶĵ���Լ�������ԭ��Ӧ���н�ɡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��Cu-Zn�����ҹ��������ʹ�õĺϽ�����п���ִ���ҵ�ϳ��ý�����
I. ij�ϴ�����58.2%��SiO2(������ˮ��ϡ��)��21.0%��ZnO��4.5%��ZnS(������ˮ������ϡ��)��12.8%��CuS(������ˮҲ������ϡ��)��ijͬѧ��15.0 g�÷ϴ���Ϊԭ�ϣ���ϡ�����H2O2Ϊ�Լ����������е�п��ͭ��
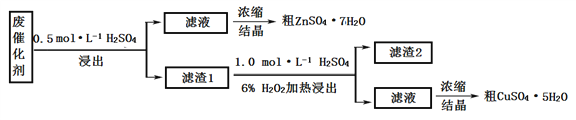
��1��������IJ����У�ʹ�õ��IJ��������У��ձ�����������__________________��
��2������2��______���ڶ��ν��������ķ�Ӧ��ѧ����ʽ��_________________________��
��3�����νᾧ�IJ�����_________________________________________________________��
��4��ijͬѧ��ʵ�����֮�õ�1.5gCuSO4��5H2O��M=250 g��mol�C1��,��ͭ�Ļ�����Ϊ_______��
II.п�Ļ�ѧ�����������ƣ�п�������ǻ��ý����������������������ǿ�ᣬ��������ǿ������������������ڰ�ˮ����������п�����ڰ�ˮ������Zn(NH3)42+���ش��������⣺
��5��Al����NaOH��Һ����Ӧ�����ӷ���ʽΪ��_______________________________��
��6��Zn����NaOH��Һ����Ӧ�Ļ�ѧ����ʽΪ��_______________________________��
��7�����и����е�������Һ������μӵ�ʵ�鷽�����ɼ������____________��
������������������ ���������Ͱ�ˮ ������п���������� ������п�Ͱ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ɢϵ�ı���������
A. ��������ֱ����1��100nm֮�� B. �������Ӵ����
C. �������Ӳ�������Ĥ D. �����ܹ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ݣ�
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 |
�Ҵ� | ��117.3 | 78.5 | 0.789 |
���� | 16.6 | 117.9 | 1.05 |
�������� | ��83.6 | 77.5 | 0.90 |
Ũ����(98%) | �� | 338.0 | 1.84 |
ʵ������ȡ������������Ҫ�������£�����30 mL�Ĵ��Թ�A�а������1��4��4�ı�������Ũ���ᡢ�Ҵ�������Ļ����Һ������ͼ1���Ӻ�װ��(װ������������)����С����ȵؼ���װ�л��Һ�Ĵ��Թ�3��5 min�������Թ�B�ռ���һ���������ֹͣ���ȣ���ȥ�Թ�B��������Ȼ���÷ֲ㣻

ͼ1
����������������㡢ϴ�Ӻ��
�������ĿҪ��ش��������⣺
��1��д����ȡ���������Ļ�ѧ����ʽ��________________________________________________________________________��
��2������ʵ���б���̼������Һ��������______(����ĸ����)��
A����Ӧ��������Ҵ�
B����Ӧ�����Ტ���ղ����Ҵ�
C�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�еĸ�С�������ڷֲ�����
D�������������ɣ���������
��3������������Ҫ��С����ȼ��ȣ�����Ҫԭ����________________________________________________________________________��
��4��ij��ѧ����С�������ͼ2��ʾ����ȡ����������װ��(����̨�����С�����װ�þ�����ȥ)��
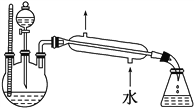
ͼ2
��ͼ1��ʾװ����ȣ���װ�õ���Ҫ�ŵ���________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֻ��ţ���CH3����OH����CHO����C6H5����COOH��������ɵ������У�����NaOH��Ӧ�������ж����֣� ��
A.4��
B.5��
C.6��
D.7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ������HNO3Ӧ����
���ᡡ ���⻯� ������� �ܺ����ᡡ���ѻӷ����ᡡ ��һԪ�ᡡ ������
A.�٢ڢۢܢݢޢ�B.�٢ܢޢ�
C.�٢ܢݢ�D.�٢ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����������ȩ����Ƴ�����ͼ��ʾ��ȼ�ϵ�أ������Ʊ���ȩ��ͬʱ��õ��ܣ����ܷ�ӦΪ��2CH2 ��CH2 + O2 �� 2CH3CHO�������й�˵����ȷ���ǣ� ��
A.a�缫������ԭ��Ӧ
B.�ŵ�ʱ��ÿת��2mol���ӣ���������Ҫ����28g��ϩ
C.b����ӦʽΪ��O2+4e-+2H2O=4OH-
D.�����ƶ����缫a��������Һ���缫b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ�������������ӡ�m��p��r������ЩԪ����ɵĶ�Ԫ�����n��Ԫ��Z�ĵ��ʣ�ͨ��Ϊ����ɫ���壬q��ˮ��Һ����Ư���ԣ�0.01mol��L-1r��Һ��pHΪ2��sͨ����������ˮ�Ļ����������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A. ԭ�Ӱ뾶�Ĵ�СW <X<Y B. Ԫ�صķǽ�����Z>X>Y
C. Y���⻯�ﳣ�³�ѹ��ΪҺ̬ D. X������������ˮ����Ϊǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.30g��ȩ��ˮ��Һ�����������Һ��ַ�Ӧ�����ɵ����У� ��
A.4.32g
B.2.16g
C.0.02g
D.0.04g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com