
【题目】已知数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | — | 338.0 | 1.84 |
实验室制取乙酸乙酯的主要步骤如下:①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min;③待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,然后静置分层;

图1
④分离出乙酸乙酯层、洗涤和干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:________________________________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要用小火均匀加热,其主要原因是________________________________________________________________________。
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),
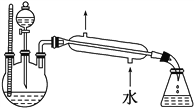
图2
与图1所示装置相比,此装置的主要优点有________________________________________________________________。
【答案】 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O BC 减少原料损失,减少副产物 增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯
CH3COOC2H5+H2O BC 减少原料损失,减少副产物 增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯
【解析】(1)实验室利用无水乙醇和乙酸在浓硫酸的催化下加热制得乙酸乙酯,制取乙酸乙酯的化学方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O; (2)饱和碳酸钠溶液的作用主要有3个:①使混入乙酸乙酯中的乙酸与Na2CO3反应而除去,②使混入的乙醇溶解.③使乙酸乙酯的溶解度减小,减少其损耗及有利于它的分层和提纯.答案选BC;(3)由题中给出的各物质的主要物理性质,根据各物质的沸点数据可知,乙酸(117.9℃)、乙醇(78.0℃)的沸点都比较低,且与乙酸乙酯的沸点(77.5℃)比较接近,若用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸出来,导致原料的大量损失;另一个方面,温度太高,可能发生其他副反应;(4)图2与图1所示装置相比,此装置的主要优点有增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯。
CH3COOC2H5+H2O; (2)饱和碳酸钠溶液的作用主要有3个:①使混入乙酸乙酯中的乙酸与Na2CO3反应而除去,②使混入的乙醇溶解.③使乙酸乙酯的溶解度减小,减少其损耗及有利于它的分层和提纯.答案选BC;(3)由题中给出的各物质的主要物理性质,根据各物质的沸点数据可知,乙酸(117.9℃)、乙醇(78.0℃)的沸点都比较低,且与乙酸乙酯的沸点(77.5℃)比较接近,若用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸出来,导致原料的大量损失;另一个方面,温度太高,可能发生其他副反应;(4)图2与图1所示装置相比,此装置的主要优点有增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯。


科目:高中化学 来源: 题型:
【题目】已知:25℃时,CH3COOH和NH3H2O的电离常数相等.
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3. ①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为 , 溶液中 ![]() (填“增大”“减小”“不变”或“不能确定”).
(填“增大”“减小”“不变”或“不能确定”).
②25℃时,0.1mol/L氨水(NH3H2O溶液)的pH= . 用pH试纸测定该氨水pH的操作方法为 .
③氨水(NH3H2O溶液)电离平衡常数表达式Kb= , 25℃时,氨水电离平衡常数约为 .
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中 ![]() (填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
当加入CH3COOH溶液体积为10mL时,混合溶液的pH7(填“>”“=”“<”).
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图.已知:pOH=﹣lgc(OH﹣). 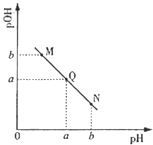
①图中M,Q,N三点所示溶液中水的电离程度最大的是(填字母).
②若Q点时滴加醋酸溶液体积为V2 mL,则V1V2(填“>”“=”“<”).
③若在曲线上某一点W时加入醋酸的体积为V1 mL,则W点应位于图中曲线上Q点的(填“上方”“下方”),此时溶液中离子浓度由大到小的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中氧化剂是 .
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,你认为必须选用的物质有 (填序号).
(3)某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式
Al+ NaNO3+ NaOH═ NaAlO2+ N2↑+ H2O
若反应过程中转移5mol 电子,则生成标准状况下N2的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大最共存的是( )
A.能使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.![]() 的溶液中:NH4+、Ca2+、Cl-、NO3-
的溶液中:NH4+、Ca2+、Cl-、NO3-
C.能与Al 反应放出H2的溶液中:Fe2+、K+、SO42-、NO3-
D.水电离的c(H+)=1×10-3mol/L的溶液中:K+、Na+、AlO2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N的晶胞结构如图,N3﹣的配位数为 , Cu+半径为acm,N3﹣半径为bcm,Cu3N的密度为gcm﹣3 . (阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物分子中,在核磁共振氢谱图中能给出一种信号的是( )
A.CH3CH2CH3
B.CH3COCH2CH3
C.CH3CH2OH
D.CH3OCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中每方框表示有关的一种反应物或生成物,方框中的字母是有关主要反应物或生成物的代码,其中C、E、G、I、X常温常压下是气体。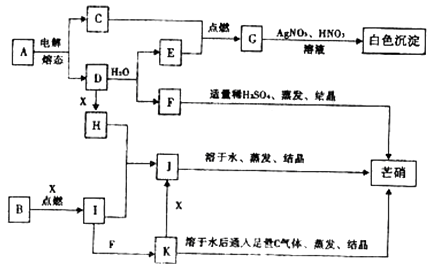
(1)B的化学式为;H的电子式为。
(2)写出A的电解方程式。
(3)写出固体H和气体I反应生成J的化学方程式,并注明电子转移的方向和数目。
(4)将C气体通入K溶液后,溶液的pH将会(填升高、降低、或不变),写出该反应的离子方程式。
(5)写出D和水反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H10的有机物,该有机物能够使酸性高锰酸钾溶液褪色,该有机物可能的结构(不考虑顺反和空间结构)有多少种( )
A.4种
B.5种
C.6种
D.7种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com