
| A. | 气体的物质的量 | B. | 气体分子之间的平均距离 | ||
| C. | 气体分子本身的大小 | D. | 气体的种类A |
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
| A. | N溶液与过量的F溶液反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E溶液与N溶液混合发生反应的离子方程式为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| C. | M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中 | |
| D. | 将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
已知:C(s)+H20(g)=CO(g)+H2(g) △H=akJ·mol—1;2C(s)+02(g)=2CO(g) △H=一220kJ·mol—1;H—H、O=0和O—H键的键能分别为436、496和462kJ·mol—1,则a为 ( )
A.—332 B.+130 C.+332 D.—l30
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:5 | B. | 3:7 | C. | 7:1 | D. | 1:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 16 g O2和O3组成的混合气体中含有的原子数为 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
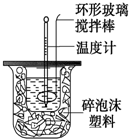 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可以做发酵粉 | |
| B. | 过氧化钠可用于呼吸面具或潜水艇中作为供氧剂 | |
| C. | 铁红常用作红色油漆或涂料 | |
| D. | 钠可以从硫酸铜溶液中置换出铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com