
| A、当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D、可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
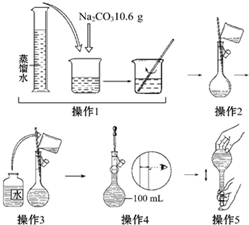
| A、所配制的Na2CO3溶液的物质的量浓度为1.0 mol?L-1 |
| B、操作2是将溶解的Na2CO3溶液转移到容量瓶中 |
| C、操作4如果仰视,结果配得溶液浓度偏低 |
| D、操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学变化中有化学键的断裂与生成,并伴有能量的变化,物理变化二者都不具备 |
| B、简单非金属阴离子只有还原性,而简单金属阳离子只有氧化性 |
| C、工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3+3HCl=FeCl3+3H2O |
| B、FeCl3+3NaOH=Fe(OH)3↓+3NaCl |
| C、Na2O+CO2=Na2CO3 |
| D、Na2O2+SO2=Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入标准状况下的HCl气体22.4V L |
| B、将溶液加热浓缩到0.5V L |
| C、加入10.00 mol?L-1的盐酸0.2V L,再稀释至1.5V L |
| D、加入V L 3 mol?L-1的盐酸混合均匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属阳离子一定只具有氧化性 |
| B、金属单质作反应物时一定不是氧化剂 |
| C、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| D、氧化还原反应中的反应物,不是氧化剂就是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由130 56Ba 可推断其原子核外电子排布及元素的相对原子质量 |
| B、通过化学变化无法实现16O2与18O2间的相互转化 |
| C、Ca(HCO3)2、Fe(OH)3、FeCl2均可通过化合反应制得 |
| D、等物质的量KMnO4和MnO2分别与足量的浓盐酸反应,前者生成氯气体积大(标况) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com