
����Ŀ��X��Y��ZΪǰ������Ԫ����X��Yλ��ͬһ������X���������в���ȱ�ٵ�Ԫ��֮һ�������γɶ��ֻ�������̬ԭ������15�ֵ����˶�״̬.Y�ĸ�һ�����ӵ�����������������ĵ�������ͬ��Z�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӡ�
��1����̬X ԭ����������ռ�ݵ�����ܲ����Ϊ_____�����ܲ��е���ռ�ݵ�������ߵĵ������ڿռ���___����չ����ԭ�ӹ����_______��.
��2������X�뵥��Y2��Ӧ����������XY3��XY5�����и�ԭ�����������8�����ȶ��ṹ�Ļ������У�Xԭ�ӵ��ӻ��������Ϊ________������ӵĿռ乹��Ϊ________��
��3��Ԫ��Z��̬ԭ�ӵĺ�������Ų�ʽΪ______����ͬ����Ԫ���У���һ��������С����____��дԪ�ط��ţ���
��4��Z��Y�γɵ�һ�ֻ����������������ͼ��ʾ.

�ٸþ����У�����____��Yԭ�����û�����Ļ�ѧʽΪ_____���辧���ⳤΪanm����˾����ܶ�Ϊ____g/cm3��д���������ʽ��Ħ��������M��ʾ������٤��������NA��ʾ��
�ڸû�����������ˮ�������ڰ�ˮ����ԭ����_________��
���𰸡� M 3 ���� sp3 ������ 1s22s22p63s23p63d104s1 K 4 CuC1 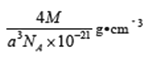 Cu+���백�γ�������ˮ����λ������
Cu+���백�γ�������ˮ����λ������
��������X���������в���ȱ�ٵ�Ԫ��֮һ�������γɶ��ֻ����������̬ԭ������15�ֵ����˶�״̬��˵��Xԭ�Ӻ�����15�����ӣ���X��PԪ�أ�X��Yλ��ͬһ������Y�ĸ�һ�����ӵ�����������������ĵ�������ͬ����Y��ClԪ�أ�Z�ǵ�������Ԫ�أ�˵��Z���ĸ����Ӳ㣬�����ֻ��1�����ӣ�����������ԭ�ӹ�����������ӣ�˵��Z��M����18�����ӣ���Z��CuԪ�ء�
(1). Pԭ�Ӻ�����15�����ӣ��������Ų������������ܲ㣬���Ե���ռ�ݵ�����ܲ����ΪM��Pԭ�ӵ������Ϊ3s23p3��p����ĵ���������ά�ռ�������x��y��z��3���������죬pԭ�ӹ��Ϊ�����Σ��ʴ�Ϊ��M��3�����壻
(2). ����P��Cl2��Ӧ����������PCl3��PCl5��PCl3��P��Clԭ�Ӿ����������8�����ȶ��ṹ��PCl3��Pԭ�ӵļ۲���Ӷ���Ϊ��3��![]() ��5��1��3��=4��Pԭ�ӵ��ӻ��������Ϊsp3����Pԭ���� 1���µ��Ӷԣ����Է��ӵĿռ乹��Ϊ�����Σ��ʴ�Ϊsp3����������
��5��1��3��=4��Pԭ�ӵ��ӻ��������Ϊsp3����Pԭ���� 1���µ��Ӷԣ����Է��ӵĿռ乹��Ϊ�����Σ��ʴ�Ϊsp3����������
(3). Z��CuԪ�أ����̬ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1����ͬһ�����У�Ԫ�صĵ�һ��������ԭ�������ĵ�������������ƣ������ڵ��������У���һ��������С����KԪ�أ��ʴ�Ϊ��1s22s22p63s23p63d104s1��K��
(4). ��. ���ݾ����ṹ�����þ�̯��������ÿ�������к�����ԭ�ӵĸ���Ϊ��8��1/8��6��1/2=4��ͭԭ�ӵĸ���Ϊ��4��1=4�����Ըû�����Ļ�ѧʽΪCuCl��������������֪��1mol�����к���4molCuCl��1mol����������Ϊ4M�������ⳤΪanm�������ܶ�Ϊ��=![]()
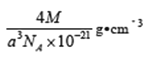 ���ʴ�Ϊ��4��CuCl��
���ʴ�Ϊ��4��CuCl��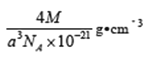 ��
��
��. ��Cu+���백�γ�������ˮ����λ���������CuCl������ˮ�������ڰ�ˮ���ʴ�Ϊ��Cu+���백�γ�������ˮ����λ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��ͨ������װ��̽��MnO2��FeCl3��6H2O�ܷ�Ӧ����Cl2��
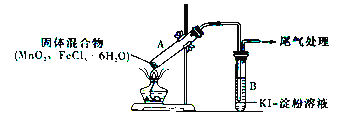
ʵ��������������±���ʾ��
ʵ���� | ���� | ���� |
ʵ��1 | ����ͼ��ʾװ�ü���MnO2��FeCl3��6H2O����� | ���Թ�A�в��ֹ����ܽ⣬�Ϸ����ְ��� ���Ժ�����ɫ���壬�ܱڸ��Ż�ɫҺ�� ���Թ�B����Һ���� |
ʵ��2 | ���Թ�A�еĻ���ﻻΪFeCl3��6H2O���Թ�B����Һ��ΪKSCN��Һ������ | �Թ�A�в��ֹ����ܽ⣬���������ͻ�ɫ���壻�Թ�B��KSCN��Һ��� |
��ش���������:
(1)ʵ��1��ʵ��2 ����������ԭ����_____________________________��
(2)ʵ��2˵����ɫ�����к���_____________(�ѧʽ)��
(3)Ϊ��һ��ȷ�ϻ�ɫ�������Ƿ���Cl2����ѧϰС���ʵ��1������ָĽ�����:
����1:���Թ�A��B������ʢ��ij���Լ���ϴ��ƿC������Թ�B ����Һ�Ա�Ϊ��ɫ��
����2:���Թ�B��KI-������Һ�滻ΪNaBr��Һ������Թ�B ����Һ�ʳȺ�ɫ����δ���Fe2+����1��ϴ��ƿC ��ʢ�ŵ��Լ���_________������2 �м���Fe2+���Լ���������______��ѡ��NaBr��Һ���Թ�B�з�������Ҫ��Ӧ�����ӷ���ʽΪ______________________________________��
(4)ʵ��1��ּ��Ⱥ������Թ�A�в������õ�Fe2O3 ��MnCl2�����Թ�A �в���Cl2 �Ļ�ѧ����ʽΪ__________________________________________����β�������ķ�����_______________________��
(5)��ѧϰС����Ϊʵ��1����Һ���������ܻ�������һ��ԭ����__________________���������ʵ�鷽����֤�˲���_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪTʱ����V L���ܱ������г���һ������A��B��������Ӧ��A��g��+B��g��C��s��+xD��g����H��0��������A��B��D�����ʵ���Ũ����ʱ��ı仯��ͼ��ʾ������˵������ȷ���ǣ�������
A.��Ӧ��ǰ10min��ƽ����Ӧ����v��B��=0.15mol/��Lmin��
B.�÷�Ӧ��ƽ�ⳣ������ʽK= ![]()
C.��ƽ��ʱ�����¶Ȳ��䣬ѹ���������ƽ�����淴Ӧ�����ƶ�
D.��Ӧ��15minʱ���ı�ķ�Ӧ�����ǽ����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴ӦX��g��+Y��g��Z��g����δ��ƽ�����¶�ΪT0ʱ�����ݻ��̶��������з�����Ӧ�����ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼa��ʾ������������ͬ���¶ȷֱ�ΪT1��T2ʱ������Ӧ��Z��Ũ����ʱ��仯�Ĺ�ϵ��ͼb��ʾ������������ȷ���ǣ�������
A.������Ӧʱ�������ʵķ�Ӧ���ʴ�С��ϵΪ��v��X��=v��Y��=2v��Z��
B.ͼa�з�Ӧ�ﵽƽ��ʱ��Y��ת����Ϊ37.5%
C.T0��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ33.3
D.�÷�Ӧ����Ӧ�ķ�Ӧ�ȡ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�
��CH3OH��g��+H2O��g���TCO2��g��+3H2��g����H=+49.0kJmol��1
��CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2��g����H=��192.9kJmol��1
O2��g���TCO2��g��+2H2��g����H=��192.9kJmol��1
����˵����ȷ���ǣ�������
A.CH3OH��ȼ����Ϊ192.9 kJmol��1
B.��Ӧ���е������仯��ͼ��ʾ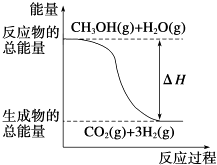
C.CH3OHת���H2�Ĺ���һ��Ҫ��������
D.���ݢ���֪��ӦCH3OH��l��+ ![]() O2��g���TCO2��g��+2H2��g���ġ�H����192.9 kJmol��1
O2��g���TCO2��g��+2H2��g���ġ�H����192.9 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ���Ҳ������ͺϳɼ�������Cu(CH3COO)��2H2O��K2C2O4��H2OΪԭ��������в�����ĥ��Ӧ�����������õ���ɫ���塣��֪����ɫ����Ļ�ѧʽΪKa[Cub(C2O4)c]��nH2O,�ںϳɹ����и���Ԫ�صĻ��ϼ۾��������仯��Ϊ�˲ⶨ����ɽ�����������ʵ�飬��ش�������⣺
��.�������ͭ�����IJⶨ
�ٽ���ɫ�������в������飬ȡ�ù����ĩ������1mol/L��H2SO4�ܽ⣬���Ƴ�250mL��Һ��
������100mL0.1000mol/LKMnO4��Һ���á�
��ȡ������Һ25.00mL����ƿ�У�����0.1000mol/LKMnO4��Һ�ζ��������ǡ��ȫ�������ɶ�����̼��������KMnO4��Һ20.00mL��
����ȡ������Һ25.00mL����ƿ�У��������KI��Һ����ַ�Ӧ����0.2000mol/LNa2S2O3��Һ�ζ�������12.50mL.(������Ӧ��2Cu2++4I-=2CuI��+I2��2Na2S2O3+I2=Na2S4O6 + 2NaI)
��1�������ᴿ����ɫ����ʱ�����������ʵ���Ҫ�ɷ� (��ԭ����)��_______���ѧʽ��
��2������0.1000mol/LKMnO4��Һ����Ҫ�IJ���������________��_______����ͷ�ιܣ����������ձ���
��3����Na2S2O3�ζ�ʱ��Ӧѡ��_______�ζ��ܣ�������ʽ��������ʽ����
��4��KMnO4��Һ�ζ�����������з�����Ӧ�����ӷ���ʽΪ_______���ζ��յ������Ϊ_____��
��.���ط������ⶨ�ᾧ�ĺ���
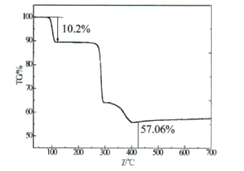
��������������������10��/min�ⶨ�û��������ʧ�����ߣ���ͼ��ʾ������107��ʧ��10.2%��ʧȥȫ���ᾧˮ��
��5��ͨ����ʧ�ط�������ɫ����Ļ�ѧʽ��n=________������ʵ��ⶨ����ɫ����Ļ�ѧʽΪ________.
��6������400��֮��ʣ�����ʵ��������ٷ����仯��Ϊ̽��ʣ�����ijɷ֣���ȴ��ȡ�����������Թ��У���ˮ�ܽ��к�ɫ��������˺�����Һ�м���ϡ���������ɫ��ζ���塣��ʣ�����ijɷ�Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ��������ҩ������Ч�ɷ��е��˲����� Re(C48H82O18)���и��Ƽ�������á��˲����� Re ����
A.����B.���C.����D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�м���������ԭ��Ӧ�������仯����ַ�����ͼ����

A. ��Ƭ��ϡ����ķ�Ӧ B. NH4Cl��Ba(OH)2��8H 2 O�ķ�Ӧ
C. ̼��ˮ������Ӧ D. �����ȼ�շ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�
SO2��g��+2CO��g�� ![]() 2CO2��g��+S��s��
2CO2��g��+S��s��
����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ���ǣ�������
A.ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ���
B.ƽ��ʱ�������������䣬�����������Ӧ���ʼӿ�
C.ƽ��ʱ���������¶ȣ�CO�������������÷�Ӧ�ġ�H��0
D.�����������䣬ʹ�ò�ͬ�������÷�Ӧƽ�ⳣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com