
����Ŀ��ijʵ���Ҳ������ͺϳɼ�������Cu(CH3COO)��2H2O��K2C2O4��H2OΪԭ��������в�����ĥ��Ӧ�����������õ���ɫ���塣��֪����ɫ����Ļ�ѧʽΪKa[Cub(C2O4)c]��nH2O,�ںϳɹ����и���Ԫ�صĻ��ϼ۾��������仯��Ϊ�˲ⶨ����ɽ�����������ʵ�飬��ش�������⣺
��.�������ͭ�����IJⶨ
�ٽ���ɫ�������в������飬ȡ�ù����ĩ������1mol/L��H2SO4�ܽ⣬���Ƴ�250mL��Һ��
������100mL0.1000mol/LKMnO4��Һ���á�
��ȡ������Һ25.00mL����ƿ�У�����0.1000mol/LKMnO4��Һ�ζ��������ǡ��ȫ�������ɶ�����̼��������KMnO4��Һ20.00mL��
����ȡ������Һ25.00mL����ƿ�У��������KI��Һ����ַ�Ӧ����0.2000mol/LNa2S2O3��Һ�ζ�������12.50mL.(������Ӧ��2Cu2++4I-=2CuI��+I2��2Na2S2O3+I2=Na2S4O6 + 2NaI)
��1�������ᴿ����ɫ����ʱ�����������ʵ���Ҫ�ɷ� (��ԭ����)��_______���ѧʽ��
��2������0.1000mol/LKMnO4��Һ����Ҫ�IJ���������________��_______����ͷ�ιܣ����������ձ���
��3����Na2S2O3�ζ�ʱ��Ӧѡ��_______�ζ��ܣ�������ʽ��������ʽ����
��4��KMnO4��Һ�ζ�����������з�����Ӧ�����ӷ���ʽΪ_______���ζ��յ������Ϊ_____��
��.���ط������ⶨ�ᾧ�ĺ���
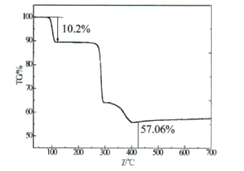
��������������������10��/min�ⶨ�û��������ʧ�����ߣ���ͼ��ʾ������107��ʧ��10.2%��ʧȥȫ���ᾧˮ��
��5��ͨ����ʧ�ط�������ɫ����Ļ�ѧʽ��n=________������ʵ��ⶨ����ɫ����Ļ�ѧʽΪ________.
��6������400��֮��ʣ�����ʵ��������ٷ����仯��Ϊ̽��ʣ�����ijɷ֣���ȴ��ȡ�����������Թ��У���ˮ�ܽ��к�ɫ��������˺�����Һ�м���ϡ���������ɫ��ζ���塣��ʣ�����ijɷ�Ϊ________��
���𰸡� CH3COOK ��Ͳ 100mL����ƿ ��ʽ 2MnO4-+5C2O42-+16H+=2Mn2++10CO2��+8H2O ���������һ���Լ�ʱ����ƿ����Һ����ɫ��ɷۺ�ɫ����30s����ɫ 2 K2[Cu(C2O4)2]��2H2O Cu��K2CO3
��������I. (1). ��Cu(CH3COO)��2H2O��K2C2O4��H2OΪԭ��������в�����ĥ��Ӧ�����������õ���ɫ���壬��֪����ɫ����Ļ�ѧʽΪKa[Cub(C2O4)c]��nH2O�����ںϳɹ����и���Ԫ�صĻ��ϼ۾��������仯������ԭ�Ϻ���ɫ����Ļ�ѧʽ��֪����ȥ��������Ҫ�ɷ���CH3COOK���ʴ�Ϊ��CH3COOK��
(2). ����100mL0.1000mol/LKMnO4��Һ���õ��IJ��������У���Ͳ���ձ�����������100mL����ƿ����ͷ�ιܵȣ��ʴ�Ϊ����Ͳ��100mL����ƿ��
(3). Na2S2O3Ϊǿ�������Σ���Һ�ʼ��ԣ�����Ӧѡ�ü�ʽ�ζ��ܣ��ʴ�Ϊ����ʽ��
(4). KMnO4��Һ�ζ���������ӹ�������MnO4������������MnԪ�ػ��ϼ۽�������Mn2����C2O42-����ԭ����CԪ�ػ��ϼ���������CO2�����ݵ�ʧ�����غ��ԭ���غ�ø÷�Ӧ�����ӷ���ʽΪ��2MnO4-+5C2O42-+16H+=2Mn2++10CO2��+8H2O�����������һ���Լ�ʱ����ƿ����Һ����ɫ��ɷۺ�ɫ����30s����ɫ��˵���ﵽ�˵ζ��յ㣬�ʴ�Ϊ��2MnO4-+5C2O42-+16H+=2Mn2++10CO2��+8H2O�����������һ���Լ�ʱ����ƿ����Һ����ɫ��ɷۺ�ɫ����30s����ɫ��
II. (5). ���������ζ����̿�֪����0.1000mol/LKMnO4��Һ�ζ������������ǡ��ȫ�������ɶ�����̼��������KMnO4��Һ20.00mL����ԭ������n��C2O42-��=0.1mol/L��0.02L��![]() ��
��![]() =0.05mol����ȡ������Һ25.00mL����ƿ�У��������KI��Һ����ַ�Ӧ����0.2000mol/LNa2S2O3��Һ�ζ�������12.50mL����2Cu2++4I-=2CuI��+I2��2Na2S2O3+I2=Na2S4O6 + 2NaI��֪��2Cu2��~I2~2 Na2S2O3����ԭ������n��Cu2����=0.0125L��0.2mol/L��
=0.05mol����ȡ������Һ25.00mL����ƿ�У��������KI��Һ����ַ�Ӧ����0.2000mol/LNa2S2O3��Һ�ζ�������12.50mL����2Cu2++4I-=2CuI��+I2��2Na2S2O3+I2=Na2S4O6 + 2NaI��֪��2Cu2��~I2~2 Na2S2O3����ԭ������n��Cu2����=0.0125L��0.2mol/L��![]() =0.025mol����n��Cu2����: n��C2O42-��=0.025mol:0.05mol=1:2������ɫ������b=1��c=2���ٸ��ݻ��ϼ�����Ϊ0����a=2��������ɫ����Ϊ��K2[Cu(C2O4)2]��nH2O��������107��ʧ��10.2%��ʧȥȫ���ᾧˮ��˵���ᾧˮ�ھ����е���������Ϊ10.2%������10.2%=
=0.025mol����n��Cu2����: n��C2O42-��=0.025mol:0.05mol=1:2������ɫ������b=1��c=2���ٸ��ݻ��ϼ�����Ϊ0����a=2��������ɫ����Ϊ��K2[Cu(C2O4)2]��nH2O��������107��ʧ��10.2%��ʧȥȫ���ᾧˮ��˵���ᾧˮ�ھ����е���������Ϊ10.2%������10.2%=![]() ��100%�����n=2������ɫ����Ļ�ѧʽΪ��K2[Cu(C2O4)2]��2H2O���ʴ�Ϊ��2��K2[Cu(C2O4)2]��nH2O��
��100%�����n=2������ɫ����Ļ�ѧʽΪ��K2[Cu(C2O4)2]��2H2O���ʴ�Ϊ��2��K2[Cu(C2O4)2]��nH2O��
(6). ��ȴ��ȡ�����������Թ��У���ˮ�ܽ��к�ɫ�����˵���е���ͭ�����˺�����Һ�м���ϡ���������ɫ��ζ���壬˵����̼��أ��ʴ�Ϊ��Cu��K2CO3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϵIJ��Ϸ�չ���Դٽ����Ľ�����
�١��칬���š��ڴ���ʹ����̼��ά���ϲ��ϣ���̼��ά���ϲ����У�̼��ά���������ǿ���ϡ�������ϡ�������Դ�մ���������﮺Ͻ�ѡ����﮺Ͻ����ѡ�����Ͻ����Ҫԭ���� ��
�ڡ��칬���š��˿�ϵͳʹ���ͷ���ʯӢ������Ϊ��ѧ���ϣ�ʯӢ������Ҫ�ɷֵĻ�ѧʽΪ ��
�۾���ϩ���ϳ�����ʳƷ��װ������ϩ�Ľṹ��ʽΪ �� ����ϩ������������ȹ��ԡ��������ԡ������ϣ�
��2015��ij�о�������һ���²�����������������������������̼�������ڼ���������ת��Ϊ���飬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������������Ϊ2.0L�ĺ����ܱ������з������·�Ӧ��PCl5��g���TPCl3��g��+Cl2��g��
��� | �¶ȣ��棩 | ��ʼ���ʵ��� | ƽ�����ʵ��� | �ﵽƽ������ʱ�� | |
PCl5��g�� | PCl3��g�� | Cl2��g�� | |||
�� | 320 | 0.40 | 0.10 | 0.10 | t1 |
�� | 320 | 0.80 | t2 | ||
�� | 410 | 0.40 | 0.15 | 0.15 | t3 |
����˵����ȷ���ǣ�������
A.ƽ�ⳣ��K��������������
B.��Ӧ����ƽ��ʱ��PCl5��ת���ʣ�������������
C.��Ӧ����ƽ��ʱ������I�е�ƽ������Ϊv��PCl5��=0.1/t1 mol/��Ls��
D.��ʼʱ���������г���PCl5 0.30 mol��PCl30.45 mol��Cl20.10 mol����Ӧ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx�Ǵ�����Ⱦ��֮һ����Ҫ��Դ�ڹ�ҵ����������β���ȡ���ȥNOx�ķ���ͳ��Ϊ������һ���иɷ�����[ѡ���Դ�����(SCR)]��ʪ�������ȡ�
������������⣺
(1)��������������ʱ��������ӦN2(g)+O2(g)![]() 2NO(g)��2000 K ʱ����̶��ݻ����ܱ������г�������ʵ�����N2��O2 ����������Ӧ��������������(��)�ı仯��ͼ1��ʾ��N2 ��ƽ��ת����Ϊ_____________��
2NO(g)��2000 K ʱ����̶��ݻ����ܱ������г�������ʵ�����N2��O2 ����������Ӧ��������������(��)�ı仯��ͼ1��ʾ��N2 ��ƽ��ת����Ϊ_____________��

(2)���ܱա��̶��ݻ��������У�һ����NO�����ֽ�Ĺ����У�NO ��ת������ʱ��仯��ϵ��ͼ2 ��ʾ��
�ٷ�Ӧ2NO(g)![]() N2(g)+O2(g) ��H_______0 (����>������<�� )��
N2(g)+O2(g) ��H_______0 (����>������<�� )��
��һ���¶��£��ܹ�˵����Ӧ2NO(g)![]() N2(g)+O2(g)�Ѵﵽ��ѧƽ���________(�����)��a.�����ڵ�ѹǿ�������仯 b.���������ܶȲ������仯
N2(g)+O2(g)�Ѵﵽ��ѧƽ���________(�����)��a.�����ڵ�ѹǿ�������仯 b.���������ܶȲ������仯
C.NO��N2��O2 ��Ũ�ȱ��ֲ��� d.2v(NO)��=v(N2 )��
(3)�ɷ�������SCR(ѡ���Դ�����)��������Ч���Ͳ��ͷ������ڿ������������µ�NO �ŷš��乤��ԭ�����£�

������[CO(NH2)2]ˮ��Һ�ȷֽ�ΪNH3��CO2���÷�Ӧ�Ļ�ѧ����ʽΪ____________��
�ڷ�Ӧ����NH3 ��ԭNO �Ļ�ѧ����ʽΪ____________________��
(4)ʪ������������NaClO2 ��Һ��Ϊ���ռ��ɶ���������������323 K �£�����������NaClO2 ��Һ��ͨ�뺬NO ����������ַ�Ӧ����Һ������Ũ�ȵķ���������±���
���� | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0��10-4 | 1.0��10-4 | 1.75��10-4 |
��NaClO2 ��Һ�Լ��ԣ������ӷ���ʽ����ԭ��_______________________��
�����ݱ������ݣ�д��NaClO2��Һ���������з����ܷ�Ӧ�����ӷ���ʽ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��ZΪǰ������Ԫ����X��Yλ��ͬһ������X���������в���ȱ�ٵ�Ԫ��֮һ�������γɶ��ֻ�������̬ԭ������15�ֵ����˶�״̬.Y�ĸ�һ�����ӵ�����������������ĵ�������ͬ��Z�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӡ�
��1����̬X ԭ����������ռ�ݵ�����ܲ����Ϊ_____�����ܲ��е���ռ�ݵ�������ߵĵ������ڿռ���___����չ����ԭ�ӹ����_______��.
��2������X�뵥��Y2��Ӧ����������XY3��XY5�����и�ԭ�����������8�����ȶ��ṹ�Ļ������У�Xԭ�ӵ��ӻ��������Ϊ________������ӵĿռ乹��Ϊ________��
��3��Ԫ��Z��̬ԭ�ӵĺ�������Ų�ʽΪ______����ͬ����Ԫ���У���һ��������С����____��дԪ�ط��ţ���
��4��Z��Y�γɵ�һ�ֻ����������������ͼ��ʾ.

�ٸþ����У�����____��Yԭ�����û�����Ļ�ѧʽΪ_____���辧���ⳤΪanm����˾����ܶ�Ϊ____g/cm3��д���������ʽ��Ħ��������M��ʾ������٤��������NA��ʾ��
�ڸû�����������ˮ�������ڰ�ˮ����ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ˮ�������е����ô�����ǣ�������
A.�ṩ����
B.��Ӫ������ˮ��ķ�Ӧ��
C.���ܼ�
D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2H4ͨ����������ĸ���ȼ�ϣ�N2O4������������ش��������⣺
��1����֪��N2��g��+2O2��g���T2NO2��g����H=+a kJ/mol
N2H4��g��+O2��g���TN2��g��+2H2O��g����H=��b kJ/mol
2NO2��g��N2O4��g����H=��c kJ/mol
д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ ��
��2��N2��H2�ϳɰ���Ϊ���ȷ�Ӧ��800Kʱ��������ʼ�����ͬ���ܱ������г���2molN2��3molH2 �� �������ڷ�Ӧ�����б���ѹǿ���䣬����������������䣬���Ǿ������������������Խ�����ѧƽ�⣮
�ٴﵽƽ��ʱ��ƽ�ⳣ��K��K��K�������������������=������
�ڴﵽƽ��ʱN2��Ũ��c��N2����c��N2���ң�c��N2����c��N2���������������������=������
�۶Լס��ҡ���������������������˵����ȷ���� ��
A�������������ܶȲ��ٱ仯ʱ��˵���˷�Ӧ�Ѵﵽƽ��״̬
B���ڼ��г���ϡ������He����ѧ��Ӧ���ʼӿ�
C����������г��백�����������ʼ�С��������������
D���������¶Ȳ��ٱ仯ʱ˵���Ѵ�ƽ��״̬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤����������ֵ������˵����ȷ���ǣ�N��14 O��16 C��12 H��1����������
A.���³�ѹ�£�46 g��NO2��N2O4������庬�е�ԭ����Ϊ3NA
B.��״���£�22.4 L CH2Cl2�к��е���ԭ����ĿΪ2NA
C.16g CH4��18 g NH4+ �������������
D.1molCu�������������з�Ӧʱת��2NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����������������ͼ��ʾ����֪���������Ҫ�ɷ���FeS2��������������

��ش��������⣺
��1��FeS2����Ԫ�صĻ��ϼ���_____________��
��2���Ӵ���������SO3�Ļ�ѧ����ʽ��_____________________��
��3���ӽӴ����г�������ѭ�����õ�������______________________��
��4����ҵ�ϲ��ð�ˮ����β���е�SO2����д��������ˮ��SO2��Ӧ�����ӷ���ʽ____________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com