
【题目】材料的不断发展可以促进社会的进步.
①“天宫二号”内大量使用了碳纤维复合材料,在碳纤维复合材料中,碳纤维属于(填“增强材料”或“基体材料”);资源舱大量采用铝锂合金,选用铝锂合金而不选用铁合金的主要原因是 .
②“天宫二号”姿控系统使用耐辐照石英玻璃作为光学材料,石英玻璃主要成分的化学式为 .
③聚乙烯塑料常用于食品包装,聚乙烯的结构简式为 , 聚乙烯塑料属于(填“热固性”或“热塑性”)塑料.
④2015年某研究机构用一种新材料镍纳米粒子作催化剂,将二氧化碳和氢气在加热条件下转化为甲烷,该反应的化学方程式为 .
【答案】增强材料;铝锂合金密度小;SiO2;![]() ;热塑性;CO2+4H2
;热塑性;CO2+4H2 ![]() 2H2O+CH4
2H2O+CH4
【解析】解:①碳纤维复合材料中,增强体为碳纤维;铝锂合金密度小于铁合金密度,所以资源舱大量采用铝锂合金而不选用铁合金;
②“天宫二号”姿控系统使用耐辐照石英玻璃作为光学材料,石英玻璃主要成分的化学式为SiO2;
③乙烯分子间发生加成聚合反应生成高分子化合物聚乙烯,结构简式为: ![]() ;其制成的塑料可以反复加热熔融加工,属于热塑性塑料;
;其制成的塑料可以反复加热熔融加工,属于热塑性塑料;
④二氧化碳和氢气在催化剂和加热的条件下反应,转化为水和甲烷,方程式:CO2+4H2 ![]() 2H2O+CH4;
2H2O+CH4;
所以答案是:①增强材料;铝锂合金密度小;
②SiO2;
③ ![]() ;热塑性;
;热塑性;
④CO2+4H2 ![]() 2H2O+CH4.
2H2O+CH4.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶体和少量杂质构成的,均属混合物。没有固定的几何外形,所以称为无定形碳,在工业上有着重要用途。回答下列问题:
(1)木炭与硫黄、火硝(硝酸钾)按一定比例混合即为黑火药。黑火药爆炸时生成硫化钾、氮气和二氧化碳。黑火药爆炸的化学方程式为____________。若有15g木炭参加反应,转移电子数为____________。
(2)工业上的炭黑是由烃类裂解而制得的高度分散性的黑色粉末状物质。
①已知几个反应的热化学方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
则由天然气生产炭黑的热化学方程式为____________。
②右图是温度对天然气生产炭黑转化率的影响,下列有关说法正确的是____________。
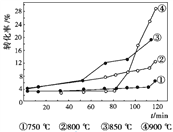
A. 甲烷裂解属于吸热反应
B. 增大体系压强,能提高甲烷的转化率
C. 在反应体系中加催化剂,反应速率增大
D. 升高温度,该反应的平衡常数减小
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1 L密闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=____________ (保留两位小数)。10~20min内,NO的平均反应速率为____________;若30 min后升高温度,达到新平衡时,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,则该反应的ΔH____________0(填“>”、“<”或“=”)。
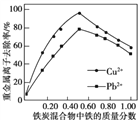
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中span>Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是____________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由NaCl、NaI、NH4Cl、Na2CO3、Na2SO3、Na2SO4中的一种或几种组成,准确称取4.7g该固体混合物进行如下实验(所加试剂均足量,气体体积已折算成标准状况下) :
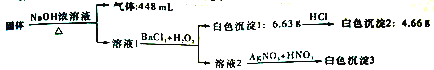
根据实验结果,下列有关说法不正确的是
A. 原固体混合物中是否含有NaCl无法确定
B. 若溶液1中只加BaCl2,则生成白色沉淀的质量必小于6.63 g
C. 原固体混合物中必含有NH4Cl、Na2CO3、Na2SO3
D. 测定出“白色沉淀3”的质量可以确定原固体混合物的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个恒容密闭容器中按下表相应量充入气体,发生反应2N2O(g) ![]() 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如下图所示:
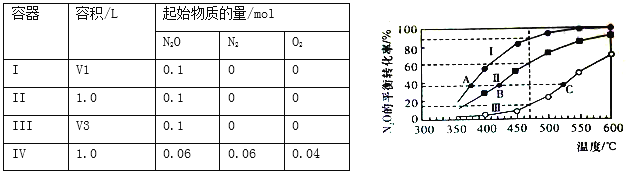
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(I)>v(II)
C. 容器IV在470℃进行反应时,起始速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)<pB(II)<pC(III)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
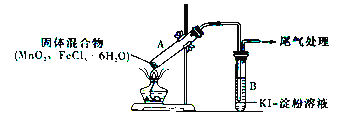
实验操作和现象如下表所示:
实验编号 | 操作 | 现象 |
实验1 | 按上图所示装置加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验2 | 把试管A中的混合物换为FeCl3·6H2O,试管B中溶液换为KSCN溶液,加热 | 试管A中部分固体溶解,产生白雾和黄色气体;试管B中KSCN溶液变红 |
请回答下列问题:
(1)实验1和实验2 产生白雾的原因是_____________________________。
(2)实验2说明黄色气体中含有_____________(填化学式)。
(3)为进一步确认黄色气体中是否含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在试管A、B间增加盛有某种试剂的洗气瓶C,结果试管B 中溶液仍变为蓝色。
方案2:将试管B中KI-淀粉溶液替换为NaBr溶液,结果试管B 中溶液呈橙红色,且未检出Fe2+。则方案1中洗气瓶C 中盛放的试剂是_________;方案2 中检验Fe2+的试剂的名称是______,选择NaBr溶液后试管B中发生的主要反应的离子方程式为______________________________________。
(4)实验1充分加热后,若将试管A中产物分离得到Fe2O3 和MnCl2,则试管A 中产生Cl2 的化学方程式为__________________________________________。其尾气处理的方法是_______________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________________。请你设计实验方案验证此猜想_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的SO2与1.25molO2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)△H<0 。30s气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是
2SO3(g)△H<0 。30s气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是
A. 达到平衡时,气体的密度是反应前的80%
B. 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为209.7g
C. 该温度下的平衡常数为101.25L/moL
D. 0~30s时SO3生成速率为3.0×10-2mol/(L.s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2.
8Cu+4FeO+2Fe2O3+16SO2.
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__(填元素符号).
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是__(注明试剂、现象).
(3)上述冶炼过程产生大量SO2.下列处理方案中合理的是__(填代号)
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是__.
(5)实验室制备,收集干燥的SO2,所需仪器如下.
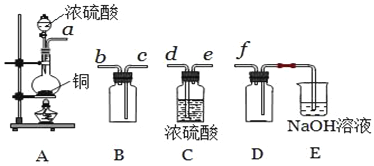
①其中装置A产生SO2,反应的化学方程式为__.
②请按气流方向连接各仪器接口,顺序为a→__→ → → f,装置E中NaOH溶液的作用是__.E中反应的离子方程式__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:

已知2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
(1)试确定:起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室采用新型合成技术,以Cu(CH3COO)·2H2O和K2C2O4·H2O为原料在玛瑙研钵中研磨反应,经过后处理得到蓝色晶体。已知该蓝色晶体的化学式为Ka[Cub(C2O4)c]·nH2O,在合成过程中各种元素的化合价均不发生变化。为了测定其组成进行以下两组实验,请回答相关问题:
Ⅰ.草酸根与铜含量的测定
①将蓝色晶体于研钵中研碎,取该固体粉末,加入1mol/L的H2SO4溶解,配制成250mL溶液。
②配制100mL0.1000mol/LKMnO4溶液备用。
③取所配溶液25.00mL于锥形瓶中,采用0.1000mol/LKMnO4溶液滴定至草酸根恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL。
④另取所配溶液25.00mL于锥形瓶中,加入过量KI溶液,充分反应后用0.2000mol/LNa2S2O3溶液滴定,消耗12.50mL.(发生反应:2Cu2++4I-=2CuI↓+I2,2Na2S2O3+I2=Na2S4O6 + 2NaI)
(1)后处理提纯该蓝色晶体时,除掉的杂质的主要成分 (除原料外)是_______(填化学式)
(2)配制0.1000mol/LKMnO4溶液,需要的玻璃仪器有________、_______,胶头滴管,玻璃棒,烧杯。
(3)用Na2S2O3滴定时,应选用_______滴定管(填“酸式”或“碱式”)
(4)KMnO4溶液滴定草酸根过程中发生反应的离子方程式为_______,滴定终点的现象为_____。
Ⅱ.热重分析法测定结晶的含量
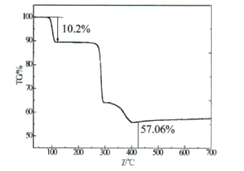
氮气气氛中以升温速率10℃/min测定该化合物的热失重曲线,如图所示晶体在107℃失重10.2%,失去全部结晶水。
(5)通过热失重分析,蓝色晶体的化学式中n=________,经过实验测定后,蓝色晶体的化学式为________.
(6)加热400℃之后,剩余物质的质量不再发生变化。为探究剩余固体的成分,冷却后取少量固体于试管中,加水溶解有红色不溶物,过滤后向滤液中加入稀盐酸产生无色无味气体。则剩余固体的成分为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com