
【题目】在四个恒容密闭容器中按下表相应量充入气体,发生反应2N2O(g) ![]() 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如下图所示:
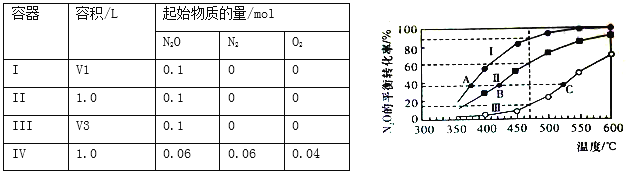
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(I)>v(II)
C. 容器IV在470℃进行反应时,起始速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)<pB(II)<pC(III)
【答案】D
【解析】A.由图像可知,随着温度的升高,平衡时N2O的转化率增大,即平衡正向移动,则该反应正向为吸热反应,A错误;B.相同温度下反应相同时间,根据反应速率的计算公式v正(N2O)= ![]() ,I的容器的体积不知道,所以无法判断v(I)和v(II)的大小,B错误;C.根据平衡常数公式k=
,I的容器的体积不知道,所以无法判断v(I)和v(II)的大小,B错误;C.根据平衡常数公式k= ,由图像可知,470℃时容器II的平衡常数k=
,由图像可知,470℃时容器II的平衡常数k=![]() =0.0675,在相同的温度下,容器II和容器IV的平衡常数相等,所以容器IV的平衡常数k=0.0675,而容器IV中初始浓度商
=0.0675,在相同的温度下,容器II和容器IV的平衡常数相等,所以容器IV的平衡常数k=0.0675,而容器IV中初始浓度商![]() =
=![]() =0.04
=0.04![]() ,所以反应正向移动,则起始速率v正(N2O)
,所以反应正向移动,则起始速率v正(N2O) ![]() v逆(N2O),C错误;D.该反应是正向体积增大的反应,由曲线变化趋势可知v(III)
v逆(N2O),C错误;D.该反应是正向体积增大的反应,由曲线变化趋势可知v(III) ![]() v(II)
v(II) ![]() v(I),所以在相同转化率下,A、B、C三点处容器内总压强的关系为:pA(I)<pB(II)<pC(III),D正确;答案选D.
v(I),所以在相同转化率下,A、B、C三点处容器内总压强的关系为:pA(I)<pB(II)<pC(III),D正确;答案选D.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】反应Fe(s)+CO2(g)FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15.下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K= ![]()
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,A和B浓度比c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin).
(1)A在5min末的浓度是多少?
(2)B的平均反应速率是多少?
(3)D的平均反应速率是多少?
(4)x值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理膳食、合理用药是人体健康的需要.
①下列营养素中,不能对人体提供能量的是(填字母).
a.维生素 b.糖类 c.蛋白质
②某肉制品包装上印有相关配料如图所示.
其中属于调味剂的是;属于发色剂的是;
属于防腐剂的是 .
③当体内胃酸分泌过多时,医生会建议服用以下常用药物中的(填字母).
a.阿司匹林 b.青霉素片 c.复方氢氧化铝片 d.合成抗菌药.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化制乙醛的实验。该小组同学查阅相关资料知:乙醛是无色有刺激性气味的液体,沸点为20.8℃,能与水、乙醇等互溶。一定条件下会被氧化成乙酸。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:________、_______。在不断鼓入空气的情况下,熄灭酒精灯后反应仍能继续进行,说明该乙醇催化反应是________反应。
(2)甲和乙两个水浴作用不相同,甲的作用是_________;乙的作用是_______。
(3)反应进行一段时间后,试管a中能收集到多种物质,它们是______。集气瓶中收集到的气体的主要成分是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.溶液中一定含Cu2+B.溶液中一定含Fe2+
C.剩余固体一定含CuD.加入KSCN溶液一定不变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展可以促进社会的进步.
①“天宫二号”内大量使用了碳纤维复合材料,在碳纤维复合材料中,碳纤维属于(填“增强材料”或“基体材料”);资源舱大量采用铝锂合金,选用铝锂合金而不选用铁合金的主要原因是 .
②“天宫二号”姿控系统使用耐辐照石英玻璃作为光学材料,石英玻璃主要成分的化学式为 .
③聚乙烯塑料常用于食品包装,聚乙烯的结构简式为 , 聚乙烯塑料属于(填“热固性”或“热塑性”)塑料.
④2015年某研究机构用一种新材料镍纳米粒子作催化剂,将二氧化碳和氢气在加热条件下转化为甲烷,该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学。
(1)近年频繁发生的有关化学品泄漏或爆炸事件一次次给我们敲响了安全警钟,操作不当就会存在安全隐患。下列做法正确的是_______________。
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;
②酒精、钠等着火,可以用水扑灭;
③如果发生氯气泄露,可用沾Na2CO3溶液的湿毛巾捂住口鼻,向上风口或地势高的地方撤离;
④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风;
⑤不慎将浓硫酸沾到皮肤上,要立即用干布拭去,再用大量水冲洗,然后涂上NaOH溶液;
⑥加热液体的试管口不能对着自己或别人;
⑦实验中当有少量的过氧化钠或金属钠剩余时,用纸包裹好后将其放入垃圾桶中
(2)某同学需要配制0.1mol·L-1 的NaHCO3溶液500mL,请根据溶液配制过程中的情况回答下列问题:
①应称取固体NaHCO3的质量为____________________。
②实验中除了托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒外还需要的其它仪器有_________________________
③定容观察液面时俯视刻度线,所配溶液浓度_______(填“偏高”、“偏低”或“无影响”)
④所配的NaHCO3溶液在保存时,常因温度过高而分解,含有少量Na2CO3,若要除去杂质Na2CO3,最简便的方法是_______,其反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是大气污染物之一,主要来源于工业烟气及汽车尾气等。除去NOx的方法统称为脱硝,一般有干法脱硝[选择性催化剂法(SCR)]、湿法脱硝等。
请完成下列问题:
(1)汽车发动机工作时会引发反应N2(g)+O2(g)![]() 2NO(g)。2000 K 时,向固定容积的密闭容器中充入等物质的量的N2、O2 发生上述反应,各组分体积分数(φ)的变化如图1所示。N2 的平衡转化率为_____________。
2NO(g)。2000 K 时,向固定容积的密闭容器中充入等物质的量的N2、O2 发生上述反应,各组分体积分数(φ)的变化如图1所示。N2 的平衡转化率为_____________。

(2)在密闭、固定容积的容器中,一定量NO发生分解的过程中,NO 的转化率随时间变化关系如图2 所示。
①反应2NO(g)![]() N2(g)+O2(g) △H_______0 (填“>”或“<” )。
N2(g)+O2(g) △H_______0 (填“>”或“<” )。
②一定温度下,能够说明反应2NO(g)![]() N2(g)+O2(g)已达到化学平衡的________(填序号)。a.容器内的压强不发生变化 b.混合气体的密度不发生变化
N2(g)+O2(g)已达到化学平衡的________(填序号)。a.容器内的压强不发生变化 b.混合气体的密度不发生变化
C.NO、N2、O2 的浓度保持不变 d.2v(NO)正=v(N2 )逆
(3)干法脱硝:SCR(选择性催化剂法)技术可有效降低柴油发动机在空气过量条件下的NO 排放。其工作原理如下:

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式为____________。
②反应器中NH3 还原NO 的化学方程式为____________________。
(4)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com