
(12分)向amol NaOH溶液中逐滴加入bmol AlCl3溶液,试回答:
(1)依次写出溶液中发生反应的化学方程式。
(2)若a+b=1,当a取不同值时,生成物可能有以下情况:
①全部是Al(OH)3时,a的取值范围是 。
②全部是NaAlO2时,a的取值范围是 。
③部分是NaAlO2,部分是Al(OH)3,a的取值范围是 。反应所生成的Al(OH)3的物质的量为 mol,反应所生成的各物质的总物质的量(包括水)为 mol(用含b的式子表示)。
④在上述条件下,若要生成7.8g沉淀,则a的值等于 或 。
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:阅读理解
 法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)
法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
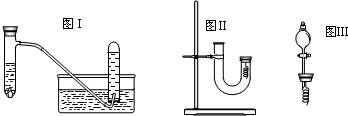
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 1 |
| 2 |
|
|
| 1 |
| 2 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方案 | 实验现象 |
| 1,用砂纸打磨后的镁条与沸水反应,再向反应液中滴加酚酞 2,向新制的H2S饱和溶液中滴加新制的氯水 3,钠与滴有酚酞试液的冷水反应 4,镁条与amol/L的盐酸反应 5,铝条与bmol/L的盐酸反应 6,向AlCl3溶液中滴加NaOH溶液至过量 |
I.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 I I.放出无色气体,气体可燃,溶液变浅红色 III.反应不十分强烈,产生的气体可燃 IV.剧烈反应,产生的气体可燃 V.生成白色絮状沉淀,继而沉淀消失 VI.生成淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com