
【题目】液氨和水类似,也能电离:NH3+NH3NH![]() +NH
+NH![]() ,25℃时其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是( )(设温度保持不变,溶液体积为仍1L)
,25℃时其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是( )(设温度保持不变,溶液体积为仍1L)
A.c(Na+)=c(NH![]() )B.c(NH
)B.c(NH![]() )=1×10-29mol/L
)=1×10-29mol/L
C.c(NH![]() )>c(NH
)>c(NH![]() )D.c(NH
)D.c(NH![]() )c(NH
)c(NH![]() )=l.0×l0-30
)=l.0×l0-30
【答案】A
【解析】
根据电荷守恒原理做答,离子积常数只与温度有关。
A.溶液中电荷守恒,所以c(Na+)+c(NH4+)=c(NH2-),A错误;
B. 2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑,促进液氨的电离,c(NH![]() )c(NH
)c(NH![]() )=l.0×l0-30;反应生成NH2-物质的量为0.1mol,浓度为0.1mol/L,所以所得溶液中NH4+的浓度l.0×l0-29mol/L,B正确;
)=l.0×l0-30;反应生成NH2-物质的量为0.1mol,浓度为0.1mol/L,所以所得溶液中NH4+的浓度l.0×l0-29mol/L,B正确;
C.c(NH2-)=0.1mol/L,c(NH4+)=l.0×l0-29mol/L,所以c(NH2-)>c(NH4+),C正确;
D.离子积常数只与温度有关,温度不变,离子积常数不变,D正确。
答案为A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的是( )
A.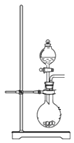 可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B.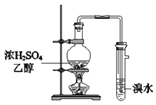 可用于制取乙烯并检验乙烯
可用于制取乙烯并检验乙烯
C.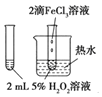 可以验证FeCl3对H2O2分解反应有催化作用
可以验证FeCl3对H2O2分解反应有催化作用
D.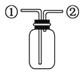 先从
先从![]() 口进气集满CO2,再从
口进气集满CO2,再从![]() 口进气,可用于收集NO
口进气,可用于收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为:
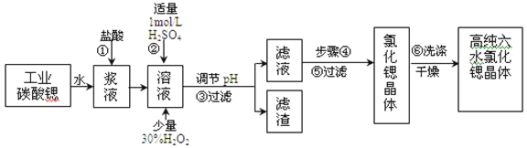
已知:I.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
II.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
⑴在步骤②中加入少量的30% H2O2,反应的离子方程式_______________。
⑵在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为__________。过滤所得滤渣的主要成分是_______________。
⑶关于上述流程中的步骤④、⑤、⑥的说法,正确的是____________。
A. 步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B. 可以通过降低结晶速率的方法来得到较大颗粒的SrCl26H2O晶体
C. 某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D. 步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和![]() 溶液
溶液
⑷工业上采用减压烘干或者用50~60℃的热风吹干SrCl26H2O晶体的原因是______________。
⑸为了测定所得SrCl26H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO3 2.38g的硝酸银溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl26H2O晶体样品的纯度。用去上述浓度的NH4SCN溶液20.00mL,则原SrCl26H2O晶体的纯度为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) ![]() 2HI(g),下列说法正确的是
2HI(g),下列说法正确的是
A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
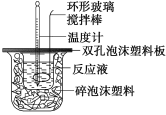
(1)烧杯间填满碎泡沫塑料的作用是_________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。
(5)倒入NaOH溶液的正确操作是 _________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为3O2![]() 2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
B.太阳能、煤气、潮汐能是一次能源;电力、蒸汽、地热是二次能源
C.吸热反应就是反应物的总能量比生成物的总能量小的反应;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少的反应
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=-566.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列说法正确的是( )
CH3COO-+H+,下列说法正确的是( )
A.向体系中加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降
B.向体系中加水稀释,平衡向右移动,溶液中所有离子的浓度都减小
C.加入少量NaOH固体(忽略溶解热效应),平衡向右移
D.加水,平衡向正向移动,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的有( )
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示标准状况时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g)![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1molH2和1molI2(g)反应生成2molHI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1molH2和1molI2(g)反应生成2molHI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的ΔH相同
A.2项B.3项C.4项D.5项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com