
【题目】下列图中的实验方案,能达到实验目的是( )
A.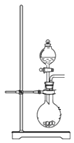 可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B.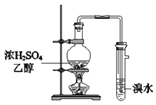 可用于制取乙烯并检验乙烯
可用于制取乙烯并检验乙烯
C.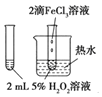 可以验证FeCl3对H2O2分解反应有催化作用
可以验证FeCl3对H2O2分解反应有催化作用
D.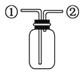 先从
先从![]() 口进气集满CO2,再从
口进气集满CO2,再从![]() 口进气,可用于收集NO
口进气,可用于收集NO
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用图装置可以探究![]() 与
与![]() 反应生成
反应生成![]() 沉淀的条件。下列判断正确的是( )
沉淀的条件。下列判断正确的是( )
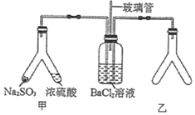
A.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B.使用Y形管甲时,应将![]() 固体转移到浓硫酸中
固体转移到浓硫酸中
C.Y形管乙中产生的为氧化性气体,将![]() 氧化为
氧化为![]() 沉淀
沉淀
D.Y形管乙中的试剂可以分别是浓氨水和NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__![]() 填序号
填序号![]() 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__![]() 用元素符号表示
用元素符号表示![]()
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。
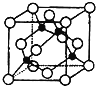
![]() 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式![]() 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水![]() 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根![]()
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是

A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___;
②在工业生产中B气体的大量排放被雨水吸收后形成了____而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是:A_____;C____。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是![]() 种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
⑴滤渣的成分是________,反应②的离子方程式是________。
⑵干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ce(OH)4的数据如下表:
干法空气氧化法 | 氧化温度 | 氧化率 | 氧化时间 |
暴露空气中 | 110~120 | 90 | 18 |
在对流空气氧化炉中 | 110~120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
⑶利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3(如图):阳极电极反应式为________,离子交换膜为________(填“阴”或“阳”)离子交换膜。
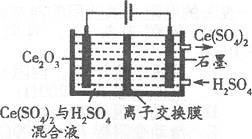
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,利用下图装置用正丁醇合成正丁醛。相关数据如下:
,利用下图装置用正丁醇合成正丁醛。相关数据如下:

物质 | 沸点/℃ | 密度/(g· | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,正确的是 ( )
A. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
B. 当温度计1示数为90~95℃,温度计2示数在117.2℃左右时,收集产物
C. 反应结束,将馏出物倒入分液漏斗中以分去水层,粗正丁醛从分液漏斗上口倒出
D. 为加快反应,应将酸化的Na2Cr2O7溶液一次性全部加入正丁醇中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SPC(2Na2CO33H2O2)具有Na2CO3和H2O2的双重性质,广泛应用于印染、医药卫生等领域。以芒硝(Na2SO410H2O)、H2O2等为原料制备SPC的工艺流程如下:
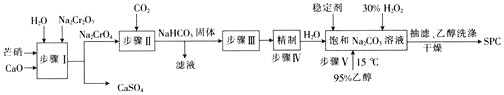
回答下列问题:
⑴步骤Ⅰ中________![]() 填“有”或“没有”
填“有”或“没有”![]() 发生氧化还原反应。
发生氧化还原反应。
⑵步骤Ⅱ中会生成一种可以循环使用的物质,该物质的化学式为________。
⑶步骤Ⅲ中需要加热,发生反应的化学方程式为_________________________________。
⑷步骤Ⅴ中,合成时需选择温度为15℃,其目的是___________。
⑸SPC的保存方法是_____________________________。
⑹过氧化氢用催化剂催化分解时生成水和氧原子,该氧原子非常活泼,称为活性氧。称量0.1600g样品,置于250mL锥形瓶中,并用100mL 0.5 mol·L-1硫酸溶解完全,立即用0.02000mol·L-1 KMnO4标准溶液滴定,滴定至终点时溶液颜色为________,且半分钟内不恢复为原来的颜色,进行三次平行实验,消耗KMnO4溶液的平均体积为26.56mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24mL。该样品的活性氧含量为_______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨和水类似,也能电离:NH3+NH3NH![]() +NH
+NH![]() ,25℃时其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是( )(设温度保持不变,溶液体积为仍1L)
,25℃时其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是( )(设温度保持不变,溶液体积为仍1L)
A.c(Na+)=c(NH![]() )B.c(NH
)B.c(NH![]() )=1×10-29mol/L
)=1×10-29mol/L
C.c(NH![]() )>c(NH
)>c(NH![]() )D.c(NH
)D.c(NH![]() )c(NH
)c(NH![]() )=l.0×l0-30
)=l.0×l0-30
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com