
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___;
②在工业生产中B气体的大量排放被雨水吸收后形成了____而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是:A_____;C____。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式____。
【答案】H2SO4 酸雨 N2 NO2 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
【解析】
根据框图,非金属单质A能发生连续氧化,含氧酸D为强酸,对应的是硫和氮等元素的转化。
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体,则A为S单质,B为SO2,C为SO3,D为H2SO4。
(2)A在常温下为气体,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3。
据此分析解答。
根据框图,非金属单质A能发生连续氧化,含氧酸D为强酸,对应的是硫和氮等元素的转化。
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体,则A为S单质,B为SO2,C为SO3,D为H2SO4。
①由以上分析可知D是硫酸,化学式为H2SO4,故答案为:H2SO4;
②在工业生产中大量排放的SO2气体被雨水吸收后形成了酸雨而污染了环境,故答案为:酸雨;
(2)若A在常温下为气体,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3。
①由以上分析可知A为N2,C为NO2,故答案为:N2;NO2;
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(Cl—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(3)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中,反应:A(g)+B(g) ![]() C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
A.A的浓度一定比原平衡小
B.A的转化率增大
C.C的体积分数一定大于原平衡C的体积分数
D.B的转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z由如下反应得到:![]() ,Z的结构简式不可能是( )
,Z的结构简式不可能是( )
A.CH3CH2CHBrCH2BrB.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3D.CH2BrCBr(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛。
(1)在2%的氢氧化钠溶液中通入氟气,发生反应:2F2+2NaOH═2NaF+H2O+OF2。该反应氧化剂与还原剂的物质的量之比为____,OF2的电子式为___。
(2)SF6是一种优良的绝缘气体材料,分子结构中只存在S-F键,已知1molS(s)转化为气态硫原子时吸收能量280kJ,形成1molF-F、S-F键需放出的能量分别为160kJ、330kJ,试写出固态S单质和氟气反应生成SF6气体的热化学方程式______。
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
(4)聚四氟化烯常用于炊具的“不粘涂层”。制备四氟化烯的反应原理为:2CHClF2(g)![]() C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)
C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)![]() C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
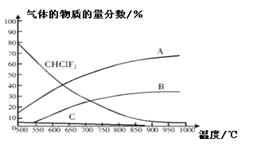
① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:_________(填标号)。
A.混合气体密度不再改变 B.混合气体平均相对分子质量不再改变
C.v正(C2F4)=2V逆(HCl) D.c(C2F4)与c(HCl)比值保持不变
② 图中曲线A表示的物质是:______(填化学式)。
③反应2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
④工业上常在900℃以上通过裂解CHClF2来制取C2F4,其原因是______。
(5)25℃时,向amol/L的NaF溶液中滴加等体积bmol/L的盐酸使溶液呈中性(不考虑盐酸与氢氟酸的挥发,忽略溶液体积变化),则HF的电离平衡常数Ka=______。(用含a和b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的是( )
A.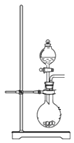 可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B.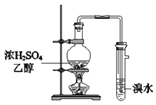 可用于制取乙烯并检验乙烯
可用于制取乙烯并检验乙烯
C.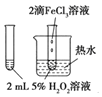 可以验证FeCl3对H2O2分解反应有催化作用
可以验证FeCl3对H2O2分解反应有催化作用
D.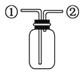 先从
先从![]() 口进气集满CO2,再从
口进气集满CO2,再从![]() 口进气,可用于收集NO
口进气,可用于收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃A在一定条件下可以进行如图所示的转化。
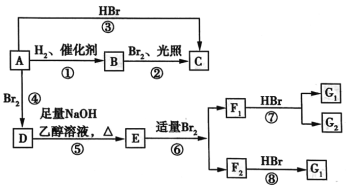
已知:D是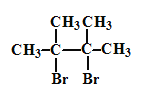 。
。
请填空:
(1)A的结构简式是________,其名称为________。
(2)图中属于取代反应的是________(填数字代号)。
(3)图中①、③、⑥属于________反应。
(4)G1的结构简式是________。
(5)写出由D→E的化学方程式:______;写出由E→F2的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
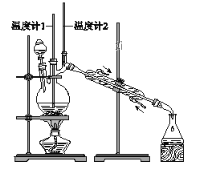
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) ![]() 2HI(g),下列说法正确的是
2HI(g),下列说法正确的是
A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com