
【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(Cl—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(3)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
【答案】Cl2(g) +2NO(g) = 2NOCl(g) ΔH =-111 kJ·mol-1 4H2S + 2NO2 = 4S↓ + N2+4H2O 6
【解析】
(1)先写出方程式,再利用H=反应物的键能总和-生成物的键能总和。
(2)根据用CH4还原SO2,硫化合价降低,得出产物,再将产物和二氧化氮利用氧化还原反应原理来书写方程式。
(3) ![]() 进行计算。
进行计算。
(1)亚硝酰氯(Cl—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为Cl2(g) +2NO(g) = 2NOCl(g) ΔH = 243 kJ·mol-1 + 630 kJ·mol-1×2 - 200 kJ·mol-1×2 -607 kJ·mol-1×2 = -111 kJ·mol-1,故答案为:Cl2(g) +2NO(g) = 2NOCl(g) ΔH =-111 kJ·mol-1。
(2)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,硫化合价降低,产物含硫质量分数约为94%的化合物为H2S,H2S和NO2反应的化学方程式为4H2S + 2NO2 = 4S↓ + N2+4H2O,故答案为:4H2S + 2NO2 = 4S↓ + N2+4H2O。
(3)25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,c(H+) = 1×10-6mol·L-1,则该混合溶液的pH=6,故答案为:6。
,c(H+) = 1×10-6mol·L-1,则该混合溶液的pH=6,故答案为:6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )(已知Ksp(AgCl)=4.0×10-10,Ksp(AgBr)=4.9×10-13,Ksp(Ag2CrO4)=2.0×10-12)
A.0.l mol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-)
B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀质量大于AgBr沉淀
C.向浓度均为1×10-3 mol/L的KCl和K2CrO4混合液中滴加1×10-3 mol/L AgNO3溶液,先生成AgCl沉淀
D.常温下,pH=4.75、浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-) = c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
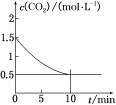
①该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________ mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用图装置可以探究![]() 与
与![]() 反应生成
反应生成![]() 沉淀的条件。下列判断正确的是( )
沉淀的条件。下列判断正确的是( )
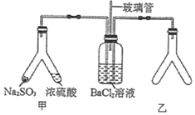
A.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B.使用Y形管甲时,应将![]() 固体转移到浓硫酸中
固体转移到浓硫酸中
C.Y形管乙中产生的为氧化性气体,将![]() 氧化为
氧化为![]() 沉淀
沉淀
D.Y形管乙中的试剂可以分别是浓氨水和NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+2B(g)![]() 2C(g),达到平衡状态的标志
2C(g),达到平衡状态的标志
A.A的分解速率和C的生成速率比为1:2
B.单位时间内生成n mol A的同时生成2n mol B
C.A、B的物质的量比为1:2
D.A、B、C的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,浓度均为1 molL-1的A2和B2两种气体,在密闭容器中反应生成气体C,反应达到平衡后,测得:c(A2)="0.58" molL-1,c(B2)="0.16" molL-1,c(C)=0.84molL-1,则该反应的正确表达式为:
A. 2A2+B2![]() 2A2B B. A2+B2
2A2B B. A2+B2![]() 2AB
2AB
C. A2+B2![]() A2B2 D. A2+2B2
A2B2 D. A2+2B2![]() 2AB2
2AB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___;
②在工业生产中B气体的大量排放被雨水吸收后形成了____而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是:A_____;C____。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com