
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
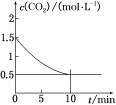
①该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________ mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
【答案】ΔH1-ΔH2 K1/K2 B、C 2.0 0.67(或2/3) A
【解析】
(1)①根据已知热化学方程式,利用盖斯定律解答;根据化学平衡常数表达式分析;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①生成物平衡浓度幂次方乘积除以反应物平衡浓度的幂次方乘积得到平衡常数表达式,代入图上数据即可求K;据K求算二氧化碳的平衡浓度;
②![]() 是该反应的平衡常数表达式,平衡常数只随温度变化,结合平衡移动原理分析判断。
是该反应的平衡常数表达式,平衡常数只随温度变化,结合平衡移动原理分析判断。
(1)①反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1 ①;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1 ①;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2 ②;①-②得CO2(g)+H2(g)
FeO(s)+H2(g) ΔH2 ②;①-②得CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=ΔH1-ΔH2;k=
CO(g)+H2O(g) ΔH=ΔH1-ΔH2;k=![]() =
=![]() ;
;
②A.CO2(g)+H2(g)![]() CO(g)+H2O(g)反应前后气体的化学计量数相等,因此压强始终为定值,故A错误;
CO(g)+H2O(g)反应前后气体的化学计量数相等,因此压强始终为定值,故A错误;
B.混合气体中c(CO)不变时,达到化学平衡,故B正确;
C.正逆反应速率相等,故C正确;
D.未说反应是正反应速率还是逆反应速率,故D错误;
答案:BC。
(2) Fe(s)+CO2(g)![]() FeO(s)+CO(g)
FeO(s)+CO(g)
c(初) 1.5 0
△c 1.0 1.0
c(平) 0.5 1.0
k=![]() =
=![]() =2;
=2;
Fe(s)+CO2(g)![]() FeO(s)+CO(g)
FeO(s)+CO(g)
c(初) 2.0 0
△c 2.0-c(CO2) 2.0-c(CO2)
c(平) c(CO2) 2.0-c(CO2)
k=![]() =2,计算得c(
=2,计算得c(
②因为k=![]() ,所以
,所以![]() 只与温度有关,正反应吸热,则温度越高,k越大,故A正确;答案:A。
只与温度有关,正反应吸热,则温度越高,k越大,故A正确;答案:A。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.硫酸铝溶液中加入过量氨水Al3++3OH- =Al(OH)3 ↓
B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+![]() = CaCO3 ↓+2OH-
= CaCO3 ↓+2OH-
C.冷的氢氧化钠溶液中通入氯气Cl2 +2OH-=ClO-+H2O +Cl-
D.稀硫酸中加入铁粉2Fe + 6H+= 2Fe3++ 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. C2H6和C4H10一定是同系物B. C2H4和C4H8一定都能使溴水退色
C. C3H6不只表示一种物质D. 烯烃中各同系物中碳的质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是![]()
![]()
A.近年屡屡引起热议的“抗糖”一词中的“糖”,指的是六大营养物质之一的糖类,由C、H、O三种元素组成
B.培育绣球花的过程中,土壤为酸性时花朵呈蓝色,土壤为碱性时花朵呈红色。为获得红色花朵,可施用硫酸铵
C.“自热火锅”极大的方便了人们的生活,自热包的主要成分为CaO,加水后反应放热,从而加热火锅
D.《神农本草经》中记载:“石膏,味辛,微寒,主中风寒热,心下逆气惊喘。“石膏”的化学式为CaSO4·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(Cl—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(3)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,三个烧瓶分别盛①混有空气的氨气、②等体积的二氧化氮与氧气的混合气、③二氧化氮,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A. 5:4:5 B. 1:1:1 C. 15: 12: 10 D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(s)+3B(g)=2C(g)+D(g),经3 min,B的浓度减少0.9 mol·L-1。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示的反应速率之比是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在2 min内的反应速率,用C表示是0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛。
(1)在2%的氢氧化钠溶液中通入氟气,发生反应:2F2+2NaOH═2NaF+H2O+OF2。该反应氧化剂与还原剂的物质的量之比为____,OF2的电子式为___。
(2)SF6是一种优良的绝缘气体材料,分子结构中只存在S-F键,已知1molS(s)转化为气态硫原子时吸收能量280kJ,形成1molF-F、S-F键需放出的能量分别为160kJ、330kJ,试写出固态S单质和氟气反应生成SF6气体的热化学方程式______。
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
(4)聚四氟化烯常用于炊具的“不粘涂层”。制备四氟化烯的反应原理为:2CHClF2(g)![]() C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)
C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)![]() C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
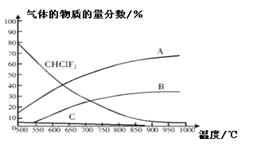
① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:_________(填标号)。
A.混合气体密度不再改变 B.混合气体平均相对分子质量不再改变
C.v正(C2F4)=2V逆(HCl) D.c(C2F4)与c(HCl)比值保持不变
② 图中曲线A表示的物质是:______(填化学式)。
③反应2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
④工业上常在900℃以上通过裂解CHClF2来制取C2F4,其原因是______。
(5)25℃时,向amol/L的NaF溶液中滴加等体积bmol/L的盐酸使溶液呈中性(不考虑盐酸与氢氟酸的挥发,忽略溶液体积变化),则HF的电离平衡常数Ka=______。(用含a和b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com