
【题目】某工业粗盐水中含有Ca2+、NH4+等杂质,可用下列方法去除(部分产物、步骤略去):
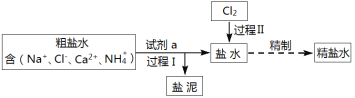
请回答下列问题:
(1)过程I中,除去粗盐水中Ca2+需加入的试剂a是______。
(2)盐泥的成分是_______。
(3)实验室由MnO2与浓盐酸混合加热制取Cl2的化学方程式是_______。
(4)若1 mol MnO2完全反应,在标准状况下生成Cl2的体积是_______L。
(5)过程II中,在碱性条件下Cl2将NH4+氧化为N2而除去,其离子方程式是_______。
【答案】Na2CO3 CaCO3 MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑ 22.4 3Cl2 + 2NH4+ + 8OH-== 6Cl- + N2 + 8H2O
MnCl2 + 2H2O + Cl2↑ 22.4 3Cl2 + 2NH4+ + 8OH-== 6Cl- + N2 + 8H2O
【解析】
粗盐水中含有Ca2+、NH4+等杂质,Ca2+可采用沉淀法除去,加入沉淀剂使Ca2+转化为难溶物碳酸钙,应注意除杂时不能引进新的杂质粒子,因此沉淀剂应采用碳酸钠;NH4+可采用氧化还原法除去,过滤后向盐水中通入氯气,使NH4+发生氧化还原反应转化为氮气。
(1)Ca2+可采用沉淀法除去,加入沉淀剂使Ca2+转化为难溶物碳酸钙,因此试剂a为Na2CO3;
(2)试剂a中的CO32—与粗盐水中的Ca2+发生反应Ca2++CO32—=CaCO3↓,因此盐泥的主要成分为CaCO3;
(3)实验室采用MnO2与浓盐酸混合加热制取少量Cl2的化学方程式为:MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑;
MnCl2 + 2H2O + Cl2↑;
(4)根据方程式MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑可知,若1 mol MnO2完全反应,则生成1mol Cl2,转化为标准状况下的体积为1mol ×22.4L/mol=22.4L;
MnCl2 + 2H2O + Cl2↑可知,若1 mol MnO2完全反应,则生成1mol Cl2,转化为标准状况下的体积为1mol ×22.4L/mol=22.4L;
(5)在碱性条件下Cl2将NH4+氧化为N2,而Cl2被还原为Cl-,因此粒子反应方程式为: 3Cl2 + 2NH4+ + 8OH-== 6Cl- + N2 + 8H2O。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】下列关于组成细胞化合物的叙述,不正确的是
A. 蛋白质肽链的盘曲和折叠被解开时,其特定功能会发生改变
B. RNA与DNA的分子结构相似,由四种核苷酸组成,可以储存遗传信息
C. 胆固醇、性激素、维生素D都属于固醇
D. 淀粉和糖原是各种生物体的储存能源物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池的构造如图所示,电池内部“→”表示放电时Li+的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC6 ![]() LiCoO2+6C,下列说法错误的是( )
LiCoO2+6C,下列说法错误的是( )
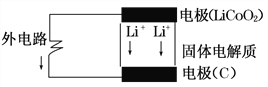
A. 该电池的负极为LiCoO2
B. 充电时Li+向C电极电极移动
C. 充电时的阴极反应:Li1-xCoO2+xLi++xe-===LiCoO2
D. 外电路上的“→”表示放电时的电子流向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4中氯元素的化合价是_______,具有_______(填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做______(填“还原剂”或“氧化剂”)。
③ NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是_______。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:
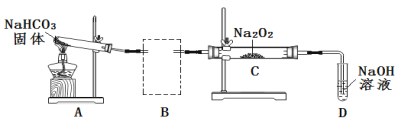
① 根据实验目的,将虚线框中的装置补充完整并标出所用的试剂_______。
② 装置C中观察到的现象是_______,反应的化学方程式是_______。
③ 装置D的作用是吸收未反应的CO2便于O2的检验。吸收CO2的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是___________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:____________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O32—+I2===S4O62—+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42—,常用作脱氯剂,该反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组利用如图装置进行电化学实验,下列预期现象正确的是
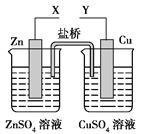
A. X和Y与电流表连接,将Zn换成Fe,测得电流更大
B. X和Y与电流表连接,将盐桥换成铜线,电流表指针偏转
C. X和Y分别与电源“+”、“-”极相连,Cu极质量增大
D. X和Y分别与电源“-”、“+”极相连,盐桥中阴离子向Zn极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com