
【题目】钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4中氯元素的化合价是_______,具有_______(填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做______(填“还原剂”或“氧化剂”)。
③ NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是_______。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:
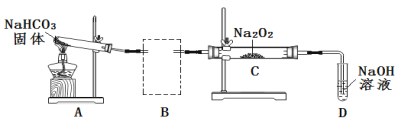
① 根据实验目的,将虚线框中的装置补充完整并标出所用的试剂_______。
② 装置C中观察到的现象是_______,反应的化学方程式是_______。
③ 装置D的作用是吸收未反应的CO2便于O2的检验。吸收CO2的离子方程式是_____。
【答案】+7 氧化性 还原剂 2NaHCO3![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑  淡黄色固体变为白色 2Na2O2 + 2CO2= 2Na2CO3 + O2 CO2 + 2OH- = CO32- + H2O(或CO2 + OH- = HCO3- )
淡黄色固体变为白色 2Na2O2 + 2CO2= 2Na2CO3 + O2 CO2 + 2OH- = CO32- + H2O(或CO2 + OH- = HCO3- )
【解析】
(1)①根据化合物的总化合价为0进行计算,物质中元素处于最高价态时,只具有氧化性,处于最低价态时,只具有还原性,处于中间价态时只有还原性,处于中间价态时既有氧化性又有还原性;
②在氧化还原反应中,根据“升失氧,降得还”进行判断氧化剂与还原剂;
③碳酸氢钠热稳定性差,受热易分解为碳酸钠,二氧化碳和水;
(2) 本实验主要探究Na2O2与CO2的反应,过氧化钠为淡黄色固体,采用碳酸氢钠的分解制备二氧化碳,但碳酸钠分解后不仅产生二氧化碳气体,还有水蒸气,而水也能与过氧化钠反应,因此应先除去二氧化碳中混有的水蒸气;干燥的二氧化碳与过氧化钠反应生成碳酸钠(白色粉末)和氧气;产生的氧气与未反应的二氧化碳通入到氢氧化钠溶液中,氧气不反应,二氧化碳为酸性氧化物,与氢氧化钠溶液发生反应,据此解题。
(1) ①KClO4中K为+1价,O为-2价,根据化合物中总化合价为0,计算得到Cl化合价为+7价,处于最高价态,因此KClO4具有氧化性;
②反应6Na + Fe2O3 =3Na2O + 2Fe中,Na由0价升为+1价,失去电子,发生氧化反应,为还原剂;
③碳酸氢钠受热易分解为碳酸钠,二氧化碳和水,反应方程式为:2NaHCO3![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
(2) ①碳酸氢钠受热易分解为碳酸钠,二氧化碳和水,本实验主要探究Na2O2与CO2的反应,应先除去水蒸气,可采用盛有浓硫酸的洗气瓶,连接方式应为长进短出,故装置图为 ;
;
②过氧化钠为淡黄色固体,与二氧化碳反应后生成碳酸钠白色粉末,因此实验现象为淡黄色固体变为白色,反应方程式为2Na2O2 + 2CO2= 2Na2CO3 + O2
③二氧化碳为酸性氧化物,与氢氧化钠溶液发生反应,当二氧化碳少量时离子方程式为CO2 + 2OH- = CO32- + H2O,当二氧化碳过量时离子方程式为 CO2 + OH- = HCO3- 。


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】将1.66 g碳酸钠和氢氧化钠的固体混合物完全溶于水配成稀溶液,然后向该溶液中逐滴加入1 mo1·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示。
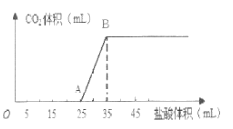
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有_________(填化学式)。
(2)当到达B点时,产生CO2的体积为 ________________ mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数________________。(写出必要计算过程,结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】泡的是山茶,品的是心性,茶的这一生,后来只凝结成一抹犹之未尽的留香于齿。其中泡茶的过程(投茶、注水、出汤、斟茶)中属于过滤操作的是( )
A.投茶B.注水C.出汤D.斟茶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业粗盐水中含有Ca2+、NH4+等杂质,可用下列方法去除(部分产物、步骤略去):
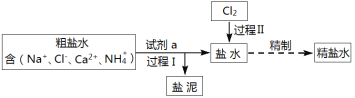
请回答下列问题:
(1)过程I中,除去粗盐水中Ca2+需加入的试剂a是______。
(2)盐泥的成分是_______。
(3)实验室由MnO2与浓盐酸混合加热制取Cl2的化学方程式是_______。
(4)若1 mol MnO2完全反应,在标准状况下生成Cl2的体积是_______L。
(5)过程II中,在碱性条件下Cl2将NH4+氧化为N2而除去,其离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 向水中通入氯气:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向氯化铁溶液中加入铜:2Fe3++3Cu===2Fe+3Cu2+
C. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求进行计算,直接写出结果
(1)标准状况下,2.24 L CH4所含氢原子的物质的量为____mol。
(2)含0.2 mol氧原子的NO2的质量是____g。
(3)100 mL 0.5mol· L-1 H2SO4溶液中,H+的物质的量浓度为____mol· L-1。
(4)1mol碳在一定量氧气中反应,生成气体的质量为36 g。所得气体的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化不能通过一步化合反应实现的是( )
A.Fe→Fe3O4B.Fe→FeCl3
C.FeCl2→Fe(OH)2D.FeCl3→FeCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com